Как сделать азотную кислоту за 15 минут в домашних условиях…
АЗОТНАЯ КИСЛОТА (HNO₃) 43 % , РЕАЛЬНО СДЕЛАТЬ ДОМА !
АЗОТНАЯ КИСЛОТА (HNO₃) 43 % , РЕАЛЬНО СДЕЛАТЬ ДОМА !
АЗОТНАЯ КИСЛОТА ЗА 5 МИНУТ! КАК СДЕЛАТЬ В ДОМАШНИХ УСЛОВИЯХ
АЗОТНАЯ КИСЛОТА ЗА 5 МИНУТ! КАК СДЕЛАТЬ В ДОМАШНИХ УСЛОВИЯХ
Химия — увлекательная наука. Те, кто интересуются не только теорией, но и пробует свои навыки на практике, точно знают, о чем идет речь. С большинством элементов из таблицы Менделеева знаком каждый школьник. Но всем ли удалось попробовать на собственном опыте смешивать реагенты и проводить химические испытания? Даже сегодня не во всех современных школах имеется в наличии необходимое оборудование и реагенты, потому химия остается наукой открытой для самостоятельного изучения. Многие стремятся познать ее глубже, проводя исследования в домашних условиях.
Ни один самодельщик не обойдется без азотной кислоты — крайне важной в хозяйстве вещи. Достать вещество сложно: приобрести его можно только в специализированном магазине, где покупка осуществляется по подтверждающим мирное использование вещества документам. Потому если вы мастер-самоделка, достать этот компонент, скорее всего, не получится. Здесь и возникает вопрос о том, как сделать азотную кислоту в домашних условиях. Процесс вроде не отличается сложностью, тем не менее на выходе должно получиться вещество достаточного уровня чистоты и необходимой концентрации. Здесь без навыков химика-экспериментатора никак не обойтись.
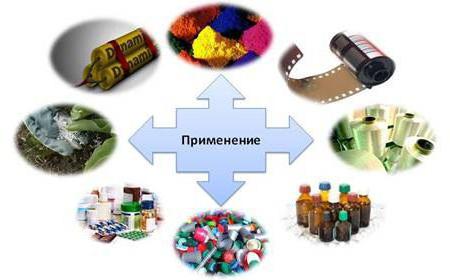
Где используется вещество?
Применение азотной кислоты разумно в безопасных целях. Вещество используется в таких сферах деятельности человека:
- создание красящих пигментов;
- проявление фотопленок;
- приготовление лекарственных препаратов;
- переработка пластиковых изделий;
- использование в химии;
- удобрение садовых и огородных культур;
- производство динамита.
Чистая азотная кислота в неизмененном виде выглядит как жидкое вещество, которое при контакте с воздухом начинает выпускать белые пары. Замерзание его происходит уже при -42 оС, а кипение — при +80 оС. Как вывести такое вещество, как азотная кислота, своими руками в домашних условиях?
Способ 1
Дымящееся вещество получают посредством воздействия концентрата серной кислоты на натриевую (калийную) селитру (натрий (калий) нитрат). В результате реакции получается искомое вещество и гидросульфат натрия (калия). Схема реакции выглядит таким образом: NaNO3+H2SO4=>HNO3+NaHSO4. Запомните, что концентрация полученного вещества зависит от концентрации серной кислоты перед вступлением в реакцию.
Способ 2
Получение азотной кислоты в домашних условиях с меньшей концентрацией вещества происходит тем же способом, необходимо только заменить натриевую селитру нитратом аммония. Химическое уравнение выглядит так: NH4NO3+H2SO4=>(NH4)2SO4+HNO3. Заметьте, что аммиачная селитра доступнее, чем калийная или натриевая, потому большинство исследователей проводят реакцию на ее основе.
Чем выше концентрация H2SO4, тем более концентрированной будет азотная кислота. Чтобы получить сбалансированное вещество, требуется увеличить объем электролита, необходимого для проведения реакции. Чтобы достичь желаемого результата, на практике пользуются методом выпаривания, который заключается в постепенном уменьшении объема электролита примерно в 4 раза от первоначального.
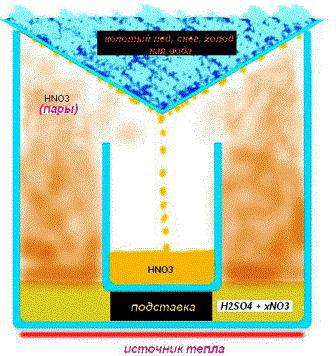
Особенности метода выпаривания
На дно посуды высыпают просеянный песок и ставят резервуар с электролитом. При этом процесс кипячения регулируют вентилем газовой плиты, поддавая или уменьшая огонь. Процесс отличается длительностью, поэтому в таком деле важно терпение. Эксперты рекомендуют использовать кипелки — стеклянные или керамические трубочки, предназначенные для проведения химических опытов, в том числе и выпаривания. Они нейтрализуют образование пузырей и снижают силу кипения, предотвращая разбрызгивание вещества. В таких условиях допустимо получение азотной кислоты в домашних условиях с концентрацией около 93 %.
Инструменты и реагенты для практического получения вещества
Для проведения реакции потребуется наличие:
- концентрированного H2SO4 (>95%) — 50 мл;
- нитрата аммония, калия, натрия;
- 100 мл емкости;
- 1000 мл контейнера;
- стеклянной воронки;
- резинки;
- водяной бани;
- колотого льда (можно заменить на снег или холодную воду);
- термометра.
Получение азотной кислоты в домашних условиях, как и проведение любой другой химической реакции, требует соблюдения мер предосторожности:
- В процессе получения азотной кислоты в домашних условиях необходимо поддерживать температуру в рамках 60-70 оС. Если превысить эти границы, кислота начнет распадаться.
- Во время проведения реакции могут выделяться пары и газы, поэтому, работая с кислотами, обязательно пользуйтесь защитной маской. Руки должны быть защищены от внезапного попадания вещества на кожу, потому химики работают в резиновых перчатках. На больших химических производствах, где человек контактирует с опасными для здоровья веществами, рабочие вообще работают в специальных защитных костюмах.
Теперь вы знаете, как получить азотную кислоту в процессе проведения простой реакции. Будьте осторожны с использованием такого вещества и применяйте его только в мирных целях.
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
16 August 2011
Автор КакПросто!
Азотная кислота – одна из самых сильных одноосновных кислот. Ее химическая формула – HNO3. Представляет собою бесцветную жидкость, «дымящую» на воздухе (при содержании самой кислоты от 95% и выше). Может иметь буроватый оттенок разной степени насыщенности, ввиду присутствия в ней оксида азота NO2. Каким образом получают азотную кислоту?
Инструкция
В отличие от прочих одноосновных кислот, реакции азотной кислоты с металлами идут по другому механизму. То есть, не выделяется водород, а образуются различные оксиды азота (NO2, NO, N2O), в зависимости от концентрации кислоты. В некоторых случаях, может выделиться чистый азот, или даже образоваться нитрат аммония. Это ее характерная особенность, о которой всегда следует помнить.
С золотом, металлами платиновой группы и с танталом азотная кислота даже концентрированная не реагирует. Однако, смесь азотной и соляной кислот (1:3 по объему) растворяет и золото, и платину. Поэтому такая смесь издревле называлась «царской водкой», то есть подразумевалось, что она одолевает даже «царя металлов» — золото. При реакции с золотом, образуется соединение HAuCl4, при реакции с платиной – H2PtCl6.
Еще в эпоху раннего средневековья, алхимики открыли метод синтеза азотной кислоты путем прокаливания смеси селитры и купороса (медного, впоследствии – железного). Разумеется, он давно устарел, и сейчас может использоваться лишь в качестве ознакомительно-демонстрационного, например, на уроках химии.
В лабораторных условиях можно получить азотную кислоту, воздействуя на калийную или натриевую селитру, то есть на калий или натрий азотнокислый концентрированной серной кислотой, при повышенной температуре. Реакция идет по такой схеме:
NaNO3 + H2SO4 = NaHSO4 + HNO3, азотная кислота выделяется в виде паров, которые улавливают.
Основной современный способ синтеза азотной кислоты основан на окислении аммиака в присутствии платиновых катализаторов с разными добавками, например, родия. Поскольку сырьем служит синтетический аммиак, эти два производства в целях экономии часто совмещают, или они находятся в непосредственной близости друг от друга. Реакции идут по такой схеме:4NH3 + 5O2 = 4NO + 6H2O (образуется окись азота двухвалентного).
2NO + O2 = 2NO2 (Окисление продукта до образования оксида азота четырехвалентного).
NO2 + O2 + H2O = HNO3 (Образование азотной кислоты).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Оформление предприятия
Химический процесс получения удобрения делится на несколько этапов:
Каждую смену должен выходить мастер по ремонту и наладке оборудования. Даже при видимой исправности необходимо осуществлять профилактический осмотр основных технологических узлов во избежание поломок и аварий на производстве.
Основные технологические комплексы, используемые для производства азотных удобрений — АС-72, АС-72М, АС-67. Их стоимость может меняться в зависимости от производительности, размера реакционной части, размера сепарационной части, покрытия внутренних комплектующих. Стартовая цена комплекта — 108 млн. руб. Приобретать новый производственный комплекс — значит существенно увеличить расходы на открытие завода. Желательно заняться поиском оборудования б/у и его последующей модернизацией.
Рассмотренный способ производства — упарочный, но можно также применять безупарочное производство аммиачных удобрений. Его существенное отличие — повышение концентрации азотной кислоты и проведение реакции под давлением 0,4Мпа. При этом производственный процесс будет состоять из этапов:
Учитывая данные факторы, спрос и состав металлов латуни более востребован, поэтому средняя цена данного металла на 1020 рублей за кг выше, чем у бронзового лома.
По этим свойствам можно отметить, что бронза крепче латуни при рассмотрении одинаково качественных сплавов.
Еще самоделки: Как сделать ракету из бумаги своими руками — фото и советы
Видео
Азотная кислота в домашних условиях
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
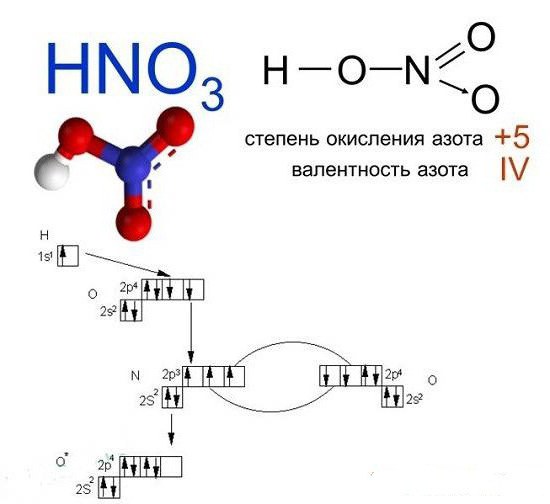
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты:
Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется постадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Особенности метода выпаривания
На дно посуды высыпают просеянный песок и ставят резервуар с электролитом. При этом процесс кипячения регулируют вентилем газовой плиты, поддавая или уменьшая огонь. Процесс отличается длительностью, поэтому в таком деле важно терпение. Эксперты рекомендуют использовать кипелки — стеклянные или керамические трубочки, предназначенные для проведения химических опытов, в том числе и выпаривания. Они нейтрализуют образование пузырей и снижают силу кипения, предотвращая разбрызгивание вещества. В таких условиях допустимо получение азотной кислоты в домашних условиях с концентрацией около 93 %.
Азотная кислота
Азотная кислота
Азотная кислота (HNO3) — одна из сильных одноосновных кислот с резким удушливым запахом, чувствительна к свету и при ярком освещении разлагается на один из оксидов азота (ещё называемый бурым газом — NO2 ) и воду. Поэтому её желательно хранить в тёмных ёмкостях. В концентрированном состоянии она не растворяет алюминий и железо, поэтому можно хранить в соответствующих металлических ёмкостях.
Азотная кислота — является сильными электролитом как многие кислоты) и очень сильный окислитель. Её часто используют при реакциях с органическими веществами.
Безводная азотная кислота — бесцветная летучая жидкость (t кип=83 °С; из-за летучести безводную азотную кислоту называют «дымящей») с резким запахом.
Азотная кислота как и озон может образовываться в атмосфере при вспышках молнии. Азот, который составляет 78% состава атмосферного воздуха, реагирует с атмосферным кислородом, образуя оксид азота NO. При дальнейшем окислении на воздухе этот оксид переходит в диоксид азота (бурый газ NO2), который реагирует с атмосферной влагой (облаками и туманом), образуя азотную кислоту . Но такое малое количество совершенно безвредно для экологии земли и живых организмов.
Один объем азотной и три объема соляной кислоты образуют соединение, называемое «царской водкой». Она способна растворять металлы (платину и золото), нерастворимые в обычных кислотах. При внесении в эту смесь бумаги, соломы, хлопка, произойдёт энергичное окисление, даже воспламенение.
При кипячении она раскладывается на составляющие компоненты (химическая реакция разложения):
HNO3 = 2NO2 +O2 + 2H2O — выделяется бурый газ (NO2), кислород и вода.

Cвойства азотной кислоты
Cвойства азотной кислоты могут быть разнообразными даже при реакциях с одним тем же веществом. Они напрямую зависят от концентрации азотной кислоты. Рассмотрим варианты химических реакций.
— азотная кислота концентрированная:
С металлами железом (Fe), хромом (Cr), алюминием (Al), золотом (Au), платиной (Pt), иридием (Ir), натрием (Na) — не взаимодействует по причине образования на их поверхности защитной плёнки, которая не позволяет дальше окисляться металлу.
Со всеми остальными металлами при химической реакции выделяется бурый газ (NO2). Например, при химической реакции с медью (Cu): 4HNO3 конц. + Cu = Cu(NO3)2 + 2NO2 + H2O С неметаллами, например с фосфором: 5HNO3 конц. + P = H3PO4 + 5NO2 + H2O
— разложения солей азотной кислоты
В зависимости от растворённого металла разложение соли при температуре происходит следующими образом: Любой металл (обозначен как Me) до магния (Mg): MeNO3 = MeNO2 + O2 Любой металл от магния (Mg) до меди (Cu): MeNO3 = MeO + NO2 + O2 Любой металл после меди (Cu): MeNO3 = Me + NO2 + O2
— азотная кислота разбавленная:
При взаимодействии с щелочно-земельными металлами, а также цинком (Zn), железом (Fe), она окисляется до аммиака (NH3) или же до аммиачной селитры (NH4NO3). Например при реакции с магнием (Mg): 10HNO3 разбавл. + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O Но может также и образовываться закись азота (N2O), например , при реакции с магнием (Mg): 10HNO3 разбавл. + 4Mg = 4Mg(NO3)2 + N2O + 5H2O С остальными металлами реагирует с образованием оксида азота (NO), например, растворяет серебро (Ag): 2HNO3 разбавл. + Ag = AgNO3 + NO + H2O Аналогично реагирует с неметаллами, например с серой: 2HNO3 разбавл. + S = H2SO4 + 2NO — окисление серы до образования серной кислоты и выделения газа оксида азота.
— химическая реакция с оксидами металлов, например, оксид кальция:
2HNO3 + CaO = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода
— химическая реакция с гидроксидами (или основаниями), например, с гашеной известью
2HNO3 + Ca(OH)2 = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода — реакция нейтрализации
— химическая реакция с солями, например с мелом:
2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2 — образуется соль (нитрат кальция) и другая кислота (в данном случае образуется угольная кислота, которая распадается на воду и углекислый газ).
Только контактные линзы acuvue moist помогут вам со зрением.