Оборудование для инкубации
Аппараты Вейса (Германия)
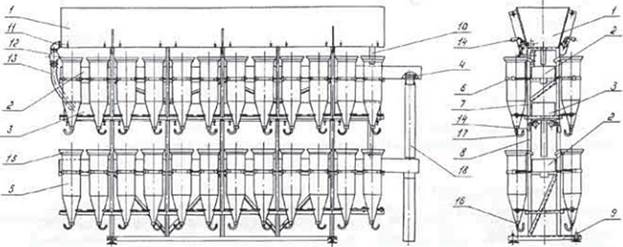
Аппараты Вейса предназначены для инкубации икры лососевых, карповых и осетровых. Рама изготовлена из нержавеющей стали. Блок поставляется готовым к установке, и опционально может быть оснащен 3/6/9/12/15 стеклянными колбами. Каждая колба имеет объём 8 литров и оснащена съемным силиконовым шлангом (безопасным для контакта с пищевыми продуктами), который позволяет контролировать подачу воды.
| Наименование | Количество колб | Ёмкость икры, тыс. шт | Габариты ДхВхШ мм |
| Аппарат Вейса | 3 | 100 | 667 x 400 x 1900 |
| 6 | 200 | 1335 x 400 x 1900 | |
| 9 | 300 | 2000 x 400 x 1900 | |
| 12 | 400 | 2665 x 400 x 1900 | |
| 15 | 500 | 3330 x 400 x 1900 |
Инкубатор Аткинса (Германия)
Компактный и экономичный инкубатор для икры лососевых. Блоки доступны в трех исполнениях с 4, 8 или 16 отсеками. Эти стеллажи отлично подходит для малогабаритных промышленных предприятий. Подача воды (примерно 2 л/мин) осуществляется из впускного патрубка, расположенного в верхнем ящике. Вода подаётся вверх, сквозь икринки, размещённые на сите внутри ящика, и выходит через боковой канал на передней стенке, попадая в нижестоящий ящик аналогичным образом, чтобы вода прошла через все ящики.
| Наименование | Количество ящиков | Ёмкость икры, тыс. шт | Габариты ДхВхШ мм |
| Инкубатор Аткинса | 4 | 50 | 600 x 640 x 440 |
| 8 | 100 | 600 x 640 x 830 | |
| 16 | 200 | 600 x 640 x 1660 |
В наличии есть только инкубаторы для лососевых россйского производства на 16 лотков
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Мы больше не будем рекомендовать вам подобный контент.
Отмена
Аппарат Коста — для инкубации икры лососевых, представляет собой продолговатый ящик (50×20×10 см), изготовленный из листового железа (рис. 52). В ящике, примерно в 5 см от дна, имеются выступы, на которые помещают рамку для икры. Рамку обтягивают сеткой. Размер ячеи сетки 18×3,5 мм. Вода поступает у одного края аппарата, свободно протекает над икрой и сливается через носик, расположенный с противоположного края. Расход воды — 0,6 л/мин. Рабочая ёмкость аппарата 2,0–2,5 тыс.шт икринок лосося. Аппараты Коста устанавливают на подставках в лестничном порядке по несколько групп в целях экономии воды и площади. В каждую группу входят 4-6 аппаратов, снабжающихся водой с одного крана. Вода из кранов поступает в верхний аппарат, а из него последовательно проходит через нижестоящие аппараты, при этом сливные носики каждого вышестоящего и нижестоящего аппаратов должны находиться с противоположных краёв. Установка в одну группу более шести аппаратов Коста не рекомендуется. Аппарат Коста прост в устройстве и удобен в эксплуатации. Недостаток – малая рабочая ёмкость.
Рис. 52. Инкубационный аппарат Коста
Калифорнийский аппарат Шустера – для инкубации икры лососей. Состоит из двух ящиков, выполненных из листового железа – наружного с глухими стенками и дном (от 50×30×18 до 103×63×19,5 см) и внутреннего (от 40×29×18 до 92×59,0×14,5 см), с дномиз металлической тканой сетки типа «Трепсе» с ячеёй 18×3,5 мм (рис. 53). С внутренних сторон наружного ящика на высоте 6 см от дна имеются выступы, на которых держится внутренний ящик. Внутренний ящик вставляется в наружный так, что его сточный носик двигается в такой же носик наружного ящика. Перед сточным носиком вставляется решётка, предохраняющая от вымывания из аппаратов икринок, которые размещены в один слой на сетчатом дне внутреннего ящика. Вода из крана поступает в наружный ящик (в промежуток в 10 см между боковой стенкой внутреннего и наружного ящика), а затем во внутренний ящик, омывая на своём пути икринки, лежащие на его сетчатом дне, далее вода сбрасывается через сливной носик. В него закладывают на инкубацию в зависимости от размеров от 5 до 30 тыс.шт. икринок лососей. Аппараты Шустера устанавливают в лестничном порядке, группами, в каждую из которых входит не более 5 аппаратов. При расходе воды 2-3 л/мин на группу лежащая в нижних аппаратах икра обеспечивается необходимым количеством кислорода.
Рис. 53. Инкубационный аппарат Шустера
1 – наружный ящик; 2 – внутренний ящик; 3 – предохранительная решётка;
4 – сточный носик
Аппапат Вильямсона — для инкубации икры лососевых, представляет собой деревянный или бетонный жёлоб с 3–6 отделениями (рис. 54). Длина желоба при трёх отделениях равна 2 м, при шести 4 м, ширина – 44 см, высота – 40 см. Отделения образованы двойными поперечными неполными перегородками. При этом каждые две перегородки, образующие отделение, установлены так, что одна из них, находящаяся ближе к притоку воды, не доходит до дна жёлоба на 5 см, а другая, находящаяся ближе к вытоку воды, наглухо закрывает дно жёлоба, но не доходит на 5 см до его краёв.
В каждом отделении помещают стопкой деревянные рамки, размером 50×50 см, обтянутые металлической сеткой и покрытые асфальтным лаком. Рамки лежат на планках, прибитых на поперечных перегородках. Самая нижняя рамка устанавливается на расстоянии 6–7 см от дна жёлоба. На каждую рамку размещают в один слой 5 тыс.шт икринок лосося, Каждое отделение аппарата вмещает 7 рамок или всего 105-210 тыс.шт икринок лосося.
Рис. 54. Инкубационный аппарат Вильямсона
1 —жёлоб; 2 — водопадача; 3 — уровень воды; 4 — неполная перегородка;
5 — рамки для икры; 6 — сливной носик; 7 — сброс воды
Поступающая из крана в аппарат вода циркулирует в каждом отделении по вертикали через рамки равномерно омывая икринки, и сбрасывается далее через сливной носик. Расход воды в аппарате — 10-12 л/мин.
Лотковый аппарат применяется для инкубации икры лососей и представляет собой прямоугольный ящик длиной 3, шириной 0,5 и высотой 0,25 м (рис. 55). Вдоль внутренних продольных сторон ящика тянутся два выступа, на которых в один ряд лежат четыре рамки размером 60×49,5 см, рамки обтянуты металлической сеткой типа «Трепсе» с ячеёй размером 18×3,5 мм. Рамки покрыты асфальтным лаком. На одну рамку помещают от 4 до 9 тыс.шт икринок лосося. Иногда, если вода содержит много ила, под рамку с икрой ставят сетчатый подрамник. Вылупившиеся предличинки падают на «подрамник, что обеспечивает содержание их в чистоте и равномерное распределение по всей площади дна аппарата. Вода поступает в аппарат сверху у одной торцовой стенки, а сбрасывается снизу через трубку, регулирующую горизонт воды у другой торговой стенки. В 15 см от каждой торцовой стенки, где попадается и сбрасывается вода, вертикально поставлена защитная сетчатая рамка-перегородка. Сетка этих рамок латунная с ячеёй 2 мм. Расход воды в аппарате 6-8 л/мин. Аппараты устанавливают в лестничном порядке, стыкуя их по два в ряд.
Рис. 55. Лотковый инкубационный аппарат
1 — водоподающая труба; 2 — защитные сетчатые решётки; 3 — уровенная трубка;
4 — сливная труба; 5 — рамки для икры;
а — общий вид двух спаренных аппаратов; б — продольный разрез аппарата
Бетонный жёлоб применяется для инкубации икры лососей. Его длина достигает 3, ширина 0,5, высота 0.3 м. Икра инкубируется в жёлобе на размещённых в один ряд 4-х рамках размером 60×49,5 см, обтянутых металлической тканой сеткой «Трепсе» с ячеёй размером 18×3,5 мм и покрытых асфальтным лаком. Рабочая ёмкость желоба, а также расход воды в нём такие же, как в лотковом аппарате. Желоба можно строить в цепном порядке с зависимым водоснабжением, стыкуя их по два или три с торцовых сторон.
Аппарат Аткинса применяется для инкубации икры лососей. Аппарат, представляет, собой деревянный или пластмассовый, ящик длиной 3,0, шириной 0,35-0,41 и высотой 0,3-0,4 м (рис. 56). Конструкция его торцевых стенок такая же, как в лотковом аппарате. Икра инкубируется в аппарате на рамках, уложенных в четыре стопки. Каждая стопка состоит из 10 рамок. На одной рамке размещается от 1,9-3,5 тыс.шт икринок. Рамки обтянуты металлической сеткой типа «Трепсе» с ячеёй 18×3,5 мм и покрыты асфальтным лаком. Размер рамки 32×32 см. Высота бортика 1 см. Две противоположные стороны бортиков каждой рамки сплошные, а две остальные имеют вырезы. Рамки укладываются гак, чтобы их бортики с вырезами располагались перпендикулярно к течению воды в аппарате. Это обеспечивает лучшую омываемость икры водой. Расход воды в аппарате 12-15 л/мин. В инкубационном цехе аппараты стыкуются по 2-3 в ряд, устанавливая их в лестничном порядке. Перед вылуплением эмбрионов в аппарате оставляют 4-6 рамок с икрой, а остальные рамки с икрой распределяют по запасным резервным аппаратам или питомникам, исходя из плотности 20-30 тыс.шт икринок на 1 м². Если вода содержит много ила, под рамки с икрой ставят сетчатые подрамники, в которых они содержатся в чистоте и равномерно распределяются по всей площади дна аппарата.
Рис. 56. Инкубационный аппарат Аткинса
1 — водоприёмная камера; 2 — рамки для икры; 3 — стойки; 4 — водосливная камера
На РЗ США и Канады вместо сетчатых рамок в инкубационных аппаратах Аткинса часто используются сетчатые корзины прямоугольной формы. Длина корзины в два раза превышает ширину, а глубина равна 10-15 см. Корзины, наполненные икрой, подвешиваются к стенкам внутри желоба. Между корзинами ставят две металлические перегородки, из которых одна не достигает поверхности воды, а другая не достигает дна. Вода поступает между перегородками и омывает икру, находящуюся в корзинах, снизу.
Ящиковые инкубационные аппараты (рис. 57) представляют собой пластмассовые прямоугольные ёмкости. Общая длина аппарата 90, ширина 65 и высота 55 см (объём 375 л). На расстоянии 80 см от задней стенки аппарата имеется перегородка, не доходящая до дна на 5 см. Эта перегородка отделяет водоприёмную камеру от ёмкости для икры. На таком же расстоянии от дна установлена сетчатая рамка, образующая второе дно ящика. Передняя стенка в верхней части имеет вырез шириной 55 и глубиной 5 см для сброса отработанной воды. Этот вырез закрыт сетчатым козырьком для предотвращения выноса икры. В ящиковом аппарате инкубируют икру осенней кеты, менее требовательную к содержанию растворённого в воде кислорода.
Аппарат заполняется икрой слоем 45 см (500 тыс.шт икринок). Вода поступает в водоприёмную камеру, затем, проходя через сетчатое дно, омывает икру и переливается через верхний вырез в противоположной стенке. Ящиковые аппараты устанавливают парами по 4 шт в ряд. Каждая последующая пара опущена вниз относительно предыдущей на 10 см.
Рис. 57. Комплекс из шести ящиковых инкубационных аппаратов
(общий размер 2900×1350×800 мм)
Аппарат дальневосточного типа применяется для инкубации икры лосося. Размеры аппаратов длина 1,6-3,0; ширина 0.35-1,4; высота 0,35-0,4 м. Икра инкубируется на рамках размером 32×32 см. Рамки обтянуты тканой металлической сеткой «Трепсе» с ячеёй 18×3,5 мм и установлены в стойках стопками. Аппараты вмещают в ширину 1-4 стопки, в длину 4-8 стопок, в каждой стопке 10 рамок с икрой и верхняя защитная рамка без икры. На одной рамке инкубируют 2,5 тыс.шт икринок горбуши или кеты (в 1,3-1,5 слоя). Аппарат ставят в лестничном порядке, обычно по три в ряд и создают зависимое водоснабжение. Расход воды в аппаратах 1,5-3,0 л/с на 1 млн. инкубируемых икринок.
Аппараты вертикального типа. Инкубационный аппарат ИМ применяется для многослойной инкубации икры форели и лососей, выдерживания предличннок до личиночного периода. Благодаря особенностям устройства аппарата и циркуляции воды в вертикальном направлении снизу вверх перпендикулярно плоскости рамки, икра размещается в 10-12 слоёв, а не в один-два слоя, как обычно. Инкубационный аппарат ИМ представляет собой 10 спаренных ёмкостей для икры, установленных одна над другой в двух секциях каркаса (по 5 шт в каждой секции) (рис. 58). Каждая ёмкость — секция инкубационного аппарата состоит из двух цилиндрических сосудов, вложенных один в другой. Внутренний сосуд предназначен для размещения икры. Он имеет сетчатое дно, приподнятое над дном внешнего сосуда, и закрывается крышкой. Внешний сосуд служит для приёма воды. В центре его возвышается труба для сбора отработанной воды и подачи её в нижележащий сосуд. Труба закрывается сетчатым колпаком. Икра укладывается на сетчатое дно внутреннего сосуда вокруг водосливной трубы слоем толщиной 6-8 см (10-15 слоёв икринок общим количеством около 30 тыс.шт) и закрывается крышкой. Заполненные икрой сосуды устанавливаются в одной из двух секций каркаса инкубационного аппарата. Вода подаётся в верхнюю секцию на крышку и в пространство между цилиндрами, затем сквозь сетчатое дно поступает к икре и достигнув уровня, равного высоте водосливной трубы, через сетчатый колпак сливается на конусную крышку нижележащей ёмкости. В аппарате совмещены процессы инкубации икры, вылупление предличинок и выдерживания их до личиночной стадии развития. Установлено, что принципиально новая конструкция этого аппарата, позволяющая имитировать естественные условия инкубации икры лососевых в нерестовых гнёздах, даёт возможность в 2-3 раза снизить отход икры, уменьшить расход воды и производственную площадь в 5-6 раз и сократить трудовые затраты в 5 раз по сравнению с действующими ныне лотковыми аппаратами.
Рис. 58. Инкубационный аппарат ИМ
а — общий вид; б — секция для икры; 1 — крышка; 2 — сетчатый колпак;
3 — водосливная труба; 4 — внутренний сосуд; 5 — икра; 6 — внешний сосуд;
7 — сетчатое дно; 8 — пространство между 6 и 7

1 — водоподводящая система; 2 — многоярусный каркас; 3 — инкубационные кюветы;
4 — рамка; 5 — сетка; 6 — канал; 7 — сбросная система; 8 — перегородка
Оригинальная конструкция кюветы инкубационного аппарата с расположением сливного жёлоба под дном позволяет значительно повысить загрузочную ёмкость аппарата. Наличие козырька у решётчатой переливной перегородки кюветы практически предотвращает потерю икры уносом её водой.
Благодаря съёмному столику и роликовым направляющим поддерживается стабильность режима инкубации, так как при движении инкубационных аппаратов во время их обслуживания в кюветах не возникает волна и не обнажается икра, что снижает отход икры.
Инкубатор вертикального типа ИВТ-М отличается от ИВТ-1 лишь конструкцией инкубационной кюветы, которая состоит из пластмассового корпуса, водорегулирующей перегородки, металлической и предохранительной сеток, сливной горловины и пробки (рис 60). Десять инкубаторов ИВТ-М может обслуживать один человек.
Рис. 60. Инкубационный аппарат инкубатора ИВТ-М
1 — корпус; 2 — водорегулирующая перегородка; 3 — металлическая сетка;
4 — предохранительная сетка; 5 — горловина; 6 — пробка
Аппараты для инкубации икры во взвешенном состоянии. Аппарат Вейса применяется для инкубации икры белорыбицы, сиговых и карповых рыб. Аппарат представляет собой стеклянный или из органического стекла сосуд, суживающийся книзу (перевёрнутая большая бутылка без дна) (рис. 61). Верхние края сосуда обтянуты обручем из оцинкованного железа. Нижнее отверстие аппарата закрыто пробкой с ввёрнутой в центре металлической трубкой диаметром 0,8-1 см. Наружный конец этой трубки соединён резиновым шлангом, по которому поступает в аппарат вода из водопроводного крана. Чтобы не было мёртвого пространства над пробкой, у стенок сосуда, где отсутствует ток воды, это место заполняют воском или менделеевской замазкой. Пробке придают нужную вогнутую форму. Токи веды, идущие из водопроводного края, поступают под напором в нижнюю часть сосуда и поднимают вверх помещённую в аппарат икру. В верхней части сосуда напор воды ослабевает, поэтому икринки начинают постепенно опускаться в нижнюю часть его, где подхватываются струями воды и вновь увлекаются вверх. Так на протяжении всего периода инкубации икра находится в непрерывном движении в толще воды. Сброс воды из аппарата происходит через сливной носик, сделанный в железном обруче, обтягивающем верхние края сосуда.
Аппарат Вейса устанавливают в стойке, имеющей два гнезда, одно из которых удерживает нижнюю часть, а другое — среднюю часть сосуда. Причём аппарат должен стоять обязательно в строго вертикальном положении. В противном случае струи воды будут направляться по одной стороне сосуда, что может вызвать неравномерное вращение икринок и заморы в отдельных частях аппарата. Аппараты Вейса обычно монтируют по 10-40 шт на одной стойке, причём для каждого из них обязательно независимое водоснабжение. Сброс воды из аппаратов осуществляется первоначально в общий водосбросной лоток, лежащий под стойкой, а из него в канализационную сеть. Для задержки икры в момент отключения водоподачи используют обратный клапан. Расход воды в аппарате 2-4 л/мин.
Рис. 61. Инкубационный аппарат Вейса:
1 — пробка; 2 — водоподающий шланг; 3 — стеклянный сосуд;
4 —металлическая трубка
Водоструйный аппарат Казанского представляет собой модернизированный аппарат Вейса. Его можно использовать для инкубации икры белорыбицы, сиговых, карповых и осетровых рыб. Вместо трубки, по которой в аппарат Вейса поступает вода, вмонтирована водоструйная головка с отверстиями — одно центральное диаметром 5 мм и шесть боковых отверстий диаметром 3 мм. По центральному отверстию в аппарат подаётся струя воды строго вертикально, а через боковые отверстия струи воды идут под углом 15° к вертикали, вдоль боковых стенок нижней части сосуда. Мёртвого пространства в нижней части сосуда нет. Регуляция подачи воды в аппарат через центральное и боковые отверстия водоструйной головки осуществляется раздельно при помощи кранов. Расход воды в аппарат 3-4,5 л/мин, рабочая ёмкость аппарата 1,23 кг икры осетровых.
Инкубатор «Уралец» Н19-ИИБ предназначен для инкубации икры сиговых рыб, а также икры карпа и карася. Отличается компактностью, что позволяет на единице площади размещать больше аппаратов Вейса, чем в других современных инкубаторах, использующих эти аппараты. Представляет собой двухярусный каркас, на котором закреплены аппараты Вейса (рис. 62).
Рис. 62. Инкубатор «Уралец»:
1 — верхний питающий лоток; 2 — сборный лоток; 3 — нижний питающий поток;
4 — пробка; 5 — аппарат Вейса; б — прижим; 7 — рама верхняя; 8 — рама нижняя;
9 — регулятор; 10 —труба переливная; 11 — угольник; 12 — вентиль; 13 — рукав;
14 — кран регулировочный; 15 — оголовок; 16 — штуцер; 17 — трубка резиновая;
18 — патрубок
Инкубационный аппарат «ИВЛ-2» предназначен для инкубации икры и выдерживания предличинок растительноядных рыб, карпа, буффало и других видов рыб (рис. 63).
Состоит из корпуса и завихрителя. Работает следующим образом:
• оплодотворённую икру загружают в инкубационный аппарат, предварительно
заполненный водой;
• устанавливают постоянный расход воды таким образом, чтобы икра находилась во
взвешенном состоянии и не выносилась из аппарата за период инкубации;
• мёртвую икру, скапливающуюся в верхней части аппарата, удаляют сифоном;
• вылупившихся предличинок выдерживают до перехода на смешанное питание, а затем
транспортируют по шлангу на разгрузочную площадку;
• после инкубации икры и выдерживания предличинок воду с отходами сливают через
патрубок.

Рис. 63. Инкубационный аппарат «ИВЛ-2»
1 — корпус; 2 — завихритель; 3 — направляющие планки
Благодаря совмещению в одном аппарате процессов инкубации икры и выдерживания предличинок в несколько раз сокращается площадь инкубационных цехов, повышается выживаемость предличинок.
Инкубатор «Амур» предназначен для инкубации икры и выдерживания предличинок растительноядных рыб, карпа, буффало и канального сома (рис 64).
1 — емкость цилиндрической формы; 2 — резиновая прокладка; 3 — шпильки с барашками; 4 — уровенная трубка; 5 — фильтрационная сетка; 6 — распорный каркас; 7 — водосборный желоб; 8 — водосливная труба (2 шт.); 9 — подставка, регулируемая по высоте;
10 — сопловый завихритель воды; 11 — конус; 12 — водораспределительный узел
Состоит из корпуса с системой водораспределения, заградительной сетки и подставки. Принцип действия инкубатора основан на инкубации икры и выдерживании предличинок в равномерном спираль-восходящем потоке воды. Этот поток создаётся за счёт конструкции узла водоподачи. Коническое дно и конус способствуют дополнительному закручиванию потока воды.
Отличается от существующих аппаратов системой водораспределения, под которой отсутствует камера, что облегчает чистку инкубатора, и креплением заградительной сетки.
Аппараты, применяемые для инкубации икры, находящейся периодически во взвешенном состоянии. Аппарат П.С. Ющенко для инкубации икры рыбца, кутума (образца 1959 г.) (рис. 65) применяется для инкубации икры и выдерживания предличинок. Основные части аппарата: инкубатор, подвижная лопасть, сифонный ковшик, фильтр аэратора и стол.
Рис. 65. Аппарат Ющенко для инкубации икры и выдерживания
Предличинок рыбца и кутума
1 — инкубатор; 2 — подвижная лопасть; 3 — стол; 4 — ковшик; 5 — аэратор
Инкубатор состоит из металлической ванны размером 140×50×15 см и вставленного в него металлического вкладыша размером 120×45×10 см с сетчатым дном с ячеёй 1-1,1 мм. Вкладыш разделён выдвижной перегородкой на две части: меньшую — инкубационную часть и большую — для вылупления предличинок. В инкубационную часть аппарата помещают 250 тыс.шт икринок.
Вода из крана водопровода (расход 7-8 л/мин) поступает на фильтр аэратора, который состоит из трёх металлических ящиков, вложенных один в другой. Подвижная лопасть аппарата, помещённая под сетчатым дном инкубационной части вкладыша, укреплена на подвижной раме, которая при помощи тяги присоединена шарнирно к рычагу коромысла. Рама движется при помощи ползунков, установленных на металлических дорожках. Последние прикреплены к металлическим стойкам, расположенным с каждой стороны стола аппарата. Следовательно, лопасть, соединённая с тягой рычагов коромысла, приводится в движение при ходе ковша. От движения лопасти возникают вихревые струи воды, которые проникают к икре снизу через сетку вкладыша. Икра хорошо омывается водой и периодически поддерживается во взвешенном состоянии. В начале инкубации икры в течение первых 5-6 ч лопасть движется один раз за 5 минут. Затем скорость движения лопасти увеличивается до одного хода в минуту. Перед началом вылупления предличинок перегородка вкладыша удаляется и икра током воды, образующимся в результате движения лопасти, размещается равномерным слоем по всему его сетчатому дну. Вылупившиеся предличинки проходят сквозь сетку вкладыша и попадают на дно ванны. Оболочки икринок задерживаются на сетке вкладыша. Движение сифонного ковшика и лопастей аппарата прекращают, когда из всей заложенной на инкубацию икры вылупляется около 2/3 предличинок. После окончания вылупления предличинок выдерживают до их перехода от придонного образа жизни к жизни в толще воды. По окончании выдерживания их выпускают из ванны через лоток вместе с водой в тару для просчёта и транспортировки к прудам, где и производится их выращивание. Аппарат Ющенко также можно использовать для инкубации икры и выдерживания предличинок других рыб, для чего нужно изменить размер сетки вкладыша в инкубаторе. Для кутума используется сетка вкладыша с ячеёй 1,25×1,25 мм и 1,4×1,4 мм. Норма загрузки икры кутума в аппарат 120-150 тыс.шт.
Инкубационный аппарат с гидроприводом для икры осетровых рыб П.С. Ющенко (Ю-IV образца 1961 г.). Основная часть аппарата — ванна длиной 70, шириной 62, высотой 21 см, которая установлена на раме, сделанной из металлических труб (рис. 66).
Рама снабжена стойками в виде ножек с небольшими колёсами. Внутри ванны помещен блок четырёх лопастей. Сверху лопастей на кронштейнах уложена сетчатая рама, ячейки которой меньше диаметра инкубируемых икринок. В ванну подают воду, а на сетчатую раму загружают до 3-4 кг икры, что соответствует примерно 150-200 тыс.шт икринок севрюги. При увеличении подачи воды в аппарат значительно сокращается период времени между двумя последующими движениями лопастей и тем самым увеличивается время пребывания икры во взвешенном состоянии в толще воды. Максимально возможный расход воды в этом аппарате равен 27 л/мин.
Рис. 66. Аппарат Ющенко (Ю-IV) для инкубации обесклеенной икры осетровых
Модернизированный аппарат системы П.С. Ющенко для инкубации икры осетровых рыб представляет собой металлический ящик, в который вставляется другой ящик с сетчатым дном. Внутренний ящик установлен так, что между его сетчатым дном и дном наружного ящика имеется наружное пространство. На дне наружного ящика установлена металлическая рама с подвижной лопастью в виде зигзагообразной поставленной на ребро пластины. Вода подаётся в наружный ящик, проходит через сетчатое дно во внутренний ящик и вытекает через сливной лоточек. Для полного спуска воды в наружном ящике имеется на дне специальный кран. Вытекающая из аппарата вода приводит в движение зигзагообразную лопасть при помощи специального передаточного механизма. Возникающие при этом вихревые токи проникают во внутренний ящик и не дают икре слеживаться. Инкубационный аппарат установлен на специальных столах по пять в одну линию, к каждому столу подведена труба для подачи воды в аппараты и устроены лотки для приёма отработанной воды (рис. 67).
Рис. 67. Схема аппарата Ющенко (Ю-11) для инкубации обесклеенной икры осетровых
1 — внутренний ящик; 2 — наружный ящик; 3 — лопасть; 4 — водоподающий кран;
5 — подвижная рама; 6 — регулятор движения лопасти; 7 — борт; 8 — водоподающая труба;
9 — водоотводящий лоток; 10 — тяга; 11 —стол
Ёмкость аппарата до 3-4 кг икры, что соответствует 150-200 тыс.шт икринок белуги, 170-215 тыс.шт икринок осетра и 250-300 тыс.шт икринок севрюги.
Универсальный аппарат Н.А. Заманова, М.А. Касимова для инкубации икры осетровых. Использование этого аппарата позволяет отказаться от строительства специального инкубационного цеха на ОРЗ, сократить количество обслуживающего персонала, исключить травмирование предличинок.
Аппарат состоит из круглого металлического каркаса диаметром 220 и высотой 30 см. Его устанавливают в обычном круглом бассейне для подращивания личинок осетровых. Внутри каркаса расположены секции (съёмные металлические ящики из оцинкованной жести, дно обтянуто латунной сеткой с ячеёй 1×1 мм).
Секции устанавливают с таким расчётом, чтобы между дном ящика и дном бассейна остался просвет 5 см для свободного перемещения лопастей пропеллера, благодаря чему икра перемешивается.
На наружной торцовой части ящика, на расстоянии 20 см от дна устанавливают сифон — металлический патрубок длиной 90 мм для автоматической выборки предличинок и подачи самотеком в бассейн для подращивания. При этом сифон выбирает только живых предличинок, мёртвые остаются на дне секции.
Лопасти пропеллера приводятся в движение с помощью механической системы, установленной над аппаратом и состоящей из ковша, противовеса, коромысла и блока конических шестерён. Вода поступает в ковш, приводя систему в движение, выливается в центральную часть аппарата и, омывая все секции, через сифон поступает в бассейн.
Один аппарат обеспечивает личинками до 30 бассейнов (30-40 тыс. предличинок на один бассейн).
Инкубатор «Осётр» предназначен для инкубации икры осетровых рыб и отделения жизнестойких предличинок после вылупления. Инкубатор «Осётр» состоит из инкубатора и сортировочного устройства, соединённых между собой в технологическую линию (рис. 68).
Инкубатор предназначен для инкубации обесклеенной икры. Принцип действия инкубатора основан на том, что рыбоводный ящик в процессе инкубации совершает вертикально возвратно-поступательные движения. В результате этих движений (колебаний) вода, поступая в рыбоводный ящик через сетчатое дно, и, проходя через слой икры снизу вверх, перемешивает последнюю. Колебания рыбоводного ящика способствуют также равномерному распределению икры в ящике с одновременной концентрацией мёртвой икры, а также сапролегнии на выходе из ящика и обеспечивает выход вылупившихся предличинок в лоток через гибкий жёлоб, которым рыбоводный ящик соединён с ёмкостью.
Рис. 68. Инкубатор «Осётр»
Сортировочное устройство предназначено для отделения жизнестойких предличинок от больных и мёртвой икры, сапролегнии. Принцип действия основан на способности жизнестойких предличинок делать вертикальные движения.
Автор Карпов Олег На чтение 2 мин. Просмотров 1.9k. Опубликовано 18.09.2020
Обновлено 18.09.2020
Для выращивания икры активно применяют аппараты Вейса. Они представляют собой стеклянный сосуд в виде бутылки стандартным объёмом 8 л. На узком конце есть пробка, в которой закреплена трубка из металла. Вода в устройство попадает под напором снизу, тем самым поддерживая икринки в подвешенности.

В каждый такой инкубатор помещают 1—4 л икры. В 1 л примерно 70 000 икринок.
Во время их взращивания в аппарате Вейса отходы равны 30-40%. В этот период за ней нужно наблюдать и постоянно удалять из воды отходы.

Перед выклевом икру из аппарата Вейса переносят в мальковые лотки при помощи шланга. Его использование обусловлено тем, что вылупившиеся личинки опускаются на дно и не могут подниматься на поверхность.

Купить оборудование для рыбоводства можно тут.
ИНКУБАЦИЯ ИКРЫ
Количество просмотров публикации ИНКУБАЦИЯ ИКРЫ — 311
Рис. 26. Получение и оплодотворение икры толстолобика, выращенного в водоеме-охладителе ЗайГРЭС.
При индустриальных методах разведения рыб инкубация икры происходит в специальных аппаратах, сконструированных таким образом, чтобы создать благоприятные условия для развития эмбрионов.
Существует много систем инкубационных аппаратов, которые можно объединить в две группы, соответствующие двум технологическим схемам. В первом случае икра обесклеивается с помощью обесклеивающих препаратов и инкубируется во взвешенном состоянии в аппаратах Вейса, ВНИИПРХа, Чеза, Цугера. Во втором случае икра инкубируется, на субстратах в прикрепленном состоянии (инкубационные аппараты Жуковского, Коста, Вильямсона, Орава, Шустера, Садова-Коханской и др.).
Аппарат Вейса представляет собой стеклянный или из органического стекла сосуд суживающийся книзу (рис.31).
Рис.31. Аппарат Вейса для инкубации икры карпа˸
а — инкубационный сосуд; б — пробка; в — медная трубка;
г — шланг водоподачи
Нижнее отверстие аппарата закрыто пробкой со вставленной по центру металлической трубкой диаметром 0,8-1,0 см. Наружный конец этой трубки соединен со шлангом, который надет на кран, подающий воду (рис.3).
Токи воды, идущие из крана, поступают под напором в нижнюю часть сосуда и поднимают вверх помещенную в аппарат икру. В верхней части сосуда напор воды ослабевает, поэтому икринки начинают постепенно опускаться в нижнюю ᴇᴦο часть, где подхватываются струями вода и вновь увлекаются вверх. Таким образом, вся икра находится во взвешенном состоянии. Сброс воды из аппарата происходит через сливной носик. сделанный в обруче, обтягивающем верхний край сосуда.
Емкость аппарата Вейса составляет 7-20 литров. Норма загрузки икры составляем 35-110 тыс.шт.Расход воды – до 6 л/мин, а перед вылуплением проточность увеличивают до 10 л/мин.
Обычно аппараты размещают на стойках в специально подготовленные гнезда. Их монтируют по 10-20 штук на одной стойке, причем для каждого из них обязательно независимое водоснабжение.
Аппараты конструкции ВНИИПРХа емкостью от 50 до 200 л используются для инкубации эмбрионов карпа и растительноядных рыб. В каждый аппарат закладывают в среднем 500 тыс. оплодотворенных икринок (примерно 500 г). Перед загрузкой в аппарате устанавливают слабую проточность воды (0,5 л/мин), а после закладки икры поступление воды в аппарат увеличивают до 4-8 л/мин.
По аналогичному принципу работают инкубационные аппараты Чеза и Цугера. Планируемый выход личинок составляет 50%, в то время как в аппаратах Вейса – 60-80%. Значительный отход икры в аппаратах большой емкости связан с тем, что икра плохо перемешивается, образуются застойные зоны, а при частом перемешивании происходит травматизация икры. Тем не менее на юге страны практикуется инкубация икры в аппаратах ВНИИПРХ, поскольку в них после карпа проводится инкубация икры растительноядных рыб, что удобно и экономично для хозяйств.
Аппарат Б.И. Казанского предназначен для инкубирования икры осетровых рыб. Он состоит из стеклянного баллона, водосбросного кольца с водосливом в верхней части баллона, водоструйной головки, сетчатого стаканчика-вкладыша. Струи воды поднимаются вверх и перемешивают икру. Емкость аппарата – 1,25 кг икры (2,5 л).
referatwork.ru
Влияние механического воздействия на икру нельмы на ранних этапах эмбрионального развития (использование разных методов инкубации икры)
Подробности
Просмотров: 99
Влияние механического воздействия на икру нельмы на ранних этапах эмбрионального развития (использование разных методов инкубации икры)
Как известно, икра сиговых рыб на ранних этапах развития довольно чувствительна к механическому воздействию. В первые сутки жизни зародыша это связано с еще неокрепшими покровами икринки, вследствие чего даже небольшой механический контакт с икрой способен нанести вред как внешней, так и внутренней оболочке (Зотин, 1961; Кугаевская, 1981, 1985; Черняев и др., 1987; Смешливая, Семенченко, 2013, 2015). Однако даже после завершения процесса набухания (оводнения) икра сохраняет восприимчивость к раздражениям механической природы. Н.Д. Никифоровым (1939) было определено, что пятиминутное сотрясение икры волховского сига на стадии морулы средних клеток приводит к гибели в среднем 15,7% икринок, в начале гаструляции – 78%, стадии формирования осевых органов – до 100% (возраст эмбрионов 18 сут., около 52 градусо-дней).
В рыбоводной практике для инкубации икры сиговых рыб традиционно применяются аппараты Вейса (его описание приведено ниже), однако выживаемость икры в них, особенно на ранних этапах эмбрионального развития, не всегда бывает удовлетворительной. Более того, сиговая икра в первое время после оплодотворения обладает высокой клейкостью даже после обработки, например, танином. В этот период в аппаратах устанавливается повышенный водообмен для упреждения комкования икры и образования застойных зон, что приводит к активной циркуляции икры, и, как следствие, к увеличению смертности эмбрионов.
С целью повышения выживаемости икры нельмы в процессе инкубации нами был опробован принципиально новый метод с применением аппаратов, предназначенных для инкубации икры форели (опыт 2012 г.) (Лютиков, Костюничев, 2013), а также модифицированные нами аппараты Вейса (опыт 2015 г).
Аппараты форелевого типа представляют собой 20-литровые емкости цилиндрической формы, в которых икра размещается на решетке, расположенной в 5-7 см от дна (рис. 9). Вода подается через шланг в нижнюю часть аппарата, равномерно распределяется по всему объему и вытекает через отверстие в его верхней части.
Закладку икры в опытные аппараты проводили спустя 10-15 мин с момента осеменения, ее объем составлял 4 л/аппарат (после набухания объем икры в аппарате увеличивался до 10 л), проточность воды ? 4 л/мин. В эксперименте было задействовано по 8 аппаратов форелевого типа и обычных восьмилитровых аппаратов Вейса, которые использовались в качестве контроля. Икру в контрольные аппараты закладывали в возрасте около 1 сут., проточность них составляла 3 л/мин. Наблюдение за развитием икры вели на живом материале.
Модифицированный аппарат Вейса представляет собой стандартный одноименный аппарат, в конусе которого устанавливается и фиксируется круглая решетка, на которой размещается икра (рис. 10). Аппарат Вейса – это стеклянный 8-литровый сосуд, нижняя треть которого сужается в виде конуса. В нижнюю горловину устанавливается штуцер, через который подается вода. В верхней части аппарата устанавливается пластиковый водосливной желоб, через который осуществляется выток воды.
Помещение икры на инкубацию осуществлялось через 16-18 ч после осеменения, ее объем в каждом аппарате составлял 4,5 л, проточность – 2,5 л/мин. Эксперимент по исследованию возможности инкубации икры нельмы в модифицированных аппаратах Вейса состоял из двух серий опытов. В первой серии было задействовано по 6 опытных и контрольных аппаратов (опыт 1), во второй серии по 4 (опыт 2). В качестве контроля, как и в опыте 2012 г. были использованы классические аппараты Вейса.
Принцип работы опытных аппаратов заключается в ослаблении влияния тока воды на икру и предотвращении ее интенсивной циркуляции. Эффективность использования форелевых аппаратов для инкубации икры нельмы была отмечена спустя 7 суток (31,6 градусо-дней) с момента оплодотворения, выживаемость зародышей в экспериментальных аппаратах в среднем равнялась 92%, в аппаратах Вейса ? 86%. Икра к этому времени находилась на этапе обрастания желтка клеточным материалом.
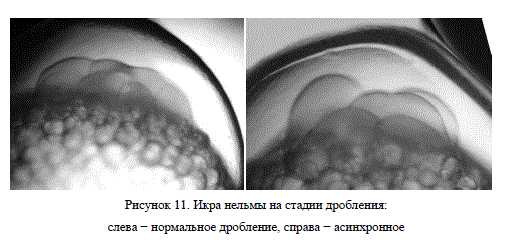
В возрасте 11 суток (47,2 градусо-дней) к началу формирования эмбриона выживаемость икры в опыте составляла 87%, в контроле 78%. Помимо относительно высокого процента гибели икры в аппаратах Вейса, ее развитие сопровождалось асинхронностью, то есть не единовременным прохождением отдельных этапов эмбриогенеза (рис. 11).
Причиной этому, как отмечалось выше, может быть высокая чувствительность икры к механическим воздействиям (сильный ток воды), а также нестабильное положение икринок в процессе инкубации, которое, по мнению некоторых авторов (Дорфман, Черданцев, 1977), способно нарушать нормальный ход развития эмбриона. Таким образом, использование аппаратов форелевого типа для инкубации икры нельмы позволяет уже на стадии формирования эмбриона увеличить ее выживаемость в среднем на 9%. Однако использование такого метода ограничено развитием сапролегнии, поражающей мертвые икринки. Из-за низкой проточности мертвая икра не выносится на поверхность, что затрудняет ее отбор и ведет к распространению сапролегнии на живую икру.
При средней температуре воды 5,0°C, продолжительность инкубации в форелевых аппаратах в наших опытах не превышала 2-х недель. В дальнейшем икра переносилась в стандартные аппараты Вейса на доинкубацию.
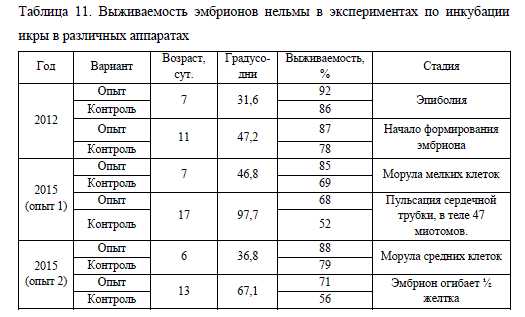
Инкубация икры нельмы в модифицированных аппаратах Вейса также позволяет увеличить выживаемость эмбрионов. Количество живой икры в них, в сравнении с использованием стандартных аппаратов, на стадии морулы было выше в среднем на 13%, а на этапе формирования эмбриона на 16%. Сравнительные данные по инкубации икры нельмы в различных аппаратах приведены в табл. 11.
Как и в случае с аппаратами форелевого типа, прекращение инкубации икры в модифицированных аппаратах Вейса в условиях рыбоводного хозяйства ООО «Форват» связано с поражением мертвой икры сапролегнией, что ограничивает использование опытных аппаратов семнадцатью днями. В дальнейшем из аппаратов вынималась решетка и продолжалась инкубация.
Последующие наблюдения за развитием икры нельмы в течение двух месяцев позволяли установить достоверную (при р ? 0,05) разницу в выживаемости икры между опытом и контролем в 15-16%.
Как видно из таблицы 11, в эксперименте 2015 г. выживаемость икры на этапе развития эмбриона в опыте 1 и 2, имеет достаточно схожие значения, тогда как в 2012 г. количество живой икры на этапе начала формирования эмбриона была на 30% больше. На наш взгляд, на разницу в выживаемости икры в большей степени повлиял не способ инкубации, а достаточно теплые температурные условия, сложившиеся осенью 2015 г. В этот год наблюдалась высокая смертность икры и у других видов сиговых, инкубация которой также проходила на рыбоводном хозяйстве ООО «Форват».
Другой причиной, негативно отразившейся на выживаемости эмбрионов нельмы, явилось то, что икру в 2015 г. получали от самок, впервые участвующих в нересте. Как известно, половые продукты впервые созревших производителей сиговых рыб в аквакультуре имеют более низкое качество, чем повторно нерестящиеся рыбы (Шумилина, 2010а, 2010б; Якубец, 2010).
При сравнении результатов инкубации икры нельмы в аппаратах форелевого типа и модифицированных аппаратах Вейса было установлено, что более предпочтительным в использовании является второй вариант. Во-первых, доработка аппаратов не составляет большого труда; во-вторых, эти же аппараты используются для доинкубации икры; в-третьих, различия в выживаемости в опытных аппаратах в сравнении с контролем составляют 15-16%, в то время как при использовании аппаратов форелевого типа – 9%. Однако применение аппаратов, предназначенных для инкубации икры форели, имеет свои преимущества, среди которых — возможность инкубировать в 1,7 раз больше икры, чем в аппарате Вейса при одинаковом расходе воды.
Анализ выживаемости икры нельмы в эксперименте позволяет предположить, что этот вид достаточно чувствителен к механическому воздействию на ранних этапах эмбрионального развития. Следовательно, для целей воспроизводства необходима разработка методики инкубации икры нельмы в условиях с минимальным механическим влиянием, что существенно повысит эффективность рыбоводных мероприятий.
Подводя итог проведенным исследованиям по воздействию некоторых факторов внешней среды на эмбриональное развития кубенской нельмы, можно заключить, что наибольшее влияние на этот процесс оказывает температура воды, которая определяет скорость развития зародыша и его физиологические особенности.
Влияние на икру освещенности зависело от ее природы. Искусственное освещение в диапазоне от 7 до 150 лк не оказывало воздействия на скорость роста, выживаемость эмбрионов, а также на длительность инкубационного периода в сравнении с естественным освещением и развитием икры в темноте. С другой стороны, отмечены достоверные различия в количестве сегментов тела у эмбрионов, развивающихся в темноте и при свете, а в случае с естественным освещением — в показателях длины и массы.
Показано, что снижение механического воздействия на икру способно существенно повысить выживаемость зародышей нельмы на стадии органогенеза. Полученные результаты свидетельствуют о том, что икра нельмы, как и других видов сиговых рыб, на ранних этапах эмбрионального развития не обладает резистентностью к механическому воздействию.
Следует отметить, что исследования влияния освещенности на развитие икры нельмы, а также инкубации икры в аппаратах форелевого типа и модифицированных нами аппаратах Вейса, в практике рыбоводства были проведены впервые.
sibir.arktikfish.com
Подготовка икры сиговых рыб к инкубации
Подготовка оплодотворенной и набухшей икры сигов к инкубации включает обесклеивание (при необходимости) и профилактическую обработку для предупреждения грибковых заболеваний.
Обесклеивание икры сигов обычно проводят в емкостях, позволяющих обеспечивать ее постоянное движение. Для этого целесообразно использовать инкубационные аппараты Вейса или его модифицированные системы (Казанского, Чеза) с восходящим током воды. Использование этих аппаратов требует тщательного контроля за направлением в них потока воды и скорости течения, которые обеспечивали бы очень слабое движение икры (без «кипения»). «Кипение» икры обычно приводит к значительному увеличению смертности эмбрионов. При прекращении движения клейкая икра очень быстро образует комочки, препятствующие ее дальнейшей подготовке к инкубации. В качестве обесклеивающего вещества целесообразно использовать тальк, мел или обезжиренное молоко. При выборе обесклеивающего вещества следует учитывать, что тальк и мел утяжеляют икру и делают ее оболочки непрозрачными. Первое нежелательно при инкубации икры в аппаратах Вейса, а второе затрудняет наблюдение за развитием эмбрионов.
Для проведения обесклеивания икры готовится суспензия обесклеивающего вещества. Суспензию из талька и мела готовят следующим образом: 75-100 г талька (мела) и 8-11 г поваренной соли смешивают с пятью литрами чистой воды, полученную смесь хорошо перемешивают. На каждый килограмм икры необходимо использовать 0.5 л густой приготовленной смеси, которую разбавляют 4 л воды.
Для приготовления обесклеивающего вещества из обезжиренного молока в него добавляют поваренную соль из расчета 2-3 г поваренной соли на 1 л молока. Приготовленную смесь следует хорошо перемешать до полного растворения соли. Подготовленная таким образом смесь молока с поваренной солью вносится в икру для обесклеивания (5 л молочной смеси на 1 кг икры).
Обесклеивание заканчивается, если икринки не будут склеиваться. Обычно на эту операцию затрачивается до 45 минут. После этого икру следует хорошо промыть чистой водой.
Для выполнения профилактических мероприятий тщательно отмытую от суспензии икру подвергают воздействию дезинфицирующего раствора. Для этого используют раствор хлорамина в концентрации 1:30000 (экспозиция 20 мин) или перекись водорода в дозировке 500-1000 мг/л (экспозиция 15 мин). Для проведения профилактики икра размещается в эмалированном тазике с небольшим количеством воды. Затем в тазик с икрой вливается используемый дезинфицирующий раствор и в зависимости от его состава икра выдерживается в нем определенное время (15-20 мин). При проведении дезинфекции необходимо очень тщательно следить за содержанием в воде кислорода. При снижении его содержания менее 5 мг/л дезинфекцию следует прекратить, а икру тщательно промыть чистой водой и заложить в инкубационные аппараты, которые предварительно дезинфицируют свежим раствором хлорной извести.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Взятие зрелых половых продуктов у производителей, осеменение икры и подготовка ее к инкубации
Проверку производителей с целью готовности их половых продуктов для рыбоводных целей начинают за 2-3 часа до предполагаемого появления первых зрелых особей. Затем этот контроль над состоянием половых желез производителей продолжают осуществлять на протяжении всего периода их выдерживания в бассейнах.
У зрелых самцов сперма вытекает при самом легком массировании брюшка по направлению к генитальному отверстию или при слабом дугообразном изгибе спины. Зрелые самки, у которых прошла полная овуляция или большинство икринок овулировано, имеют мягкое брюшко.
При опускании этих самок вниз головой икра свободно переливается в полости тела, что можно наблюдать по перемещенью вздутия брюшка к голове.
При поднятии самок вверх головой или при легком массировании их брюшка в сторону задней части тела из генитального отверстия вытекает полостная жидкость с икрой.
По мере появления зрелых самок с овулированной икрой и зрелых самцов с текучей спермой их вынимают из бассейнов, помещают в брезентовые носилки с водой и доставляют в операционное отделение при инкубационном цехе, где берут у производителей зрелые половые продукты [1].
Зрелые половые продукты берут у производителя комбинированным способом. При этом способе основную часть половых продуктов берут у рыбы способом отцеживания, а оставшуюся часть – путем вскрытия брюшной полости. Во избежание ухудшения товарной ценности рыбы разрез делают вдоль боковой линии. При отборе половых продуктов у производителей следует избегать прямых солнечных лучей и яркого электрического освещения, температура воздуха должна быть близкой к температуре воды [1].
У самок сначала берут икру путем отцеживания. Перед взятием икры голову и хвостовой стебель обёртывают марлей. Если самка небольшая, икру отцеживает один человек. Он прижимает голову рыбы локтем левой руки к телу, а кистью этой руки держит хвостовой стебель в таком положении, чтобы генитальное отверстие находилось над краем чистой и сухой посуды (эмалированный таз с неотбитой эмалью или пластмассовый таз). Сдавив осторожно пальцами правой руки брюхо рыбы, проводят ими в направлении от головы к генитальному отверстию.
Зрелая икра свободно вытекает струёй в подставленный таз. Рыбу нужно держать таким образом, чтобы икра попадала на край подставленной посуды (нельзя допускать прямого попадания икринок с высоты более 1 см, так как они легко повреждаются).
Отцеживают икру до тех пор, пока не прекратится выделение свободных икринок. Нельзя брать икру с кровью.
Если самка крупная, то икру отцеживают два человека: один держит голову рыбы, другой держит над краем посуды хвостовой стебель и одновременно свободной рукой отцеживает икру.
Оставшуюся часть икры берут путем вскрытия брюшной полости, делая разрез вдоль боковой линии.
Икру отцеживают в сухие тазы. В один таз можно отцедить 3-4 кг икры [1].
Таким же способом берут и сперму у самцов. Существует очень удобный способ взятия спермы с помощью шприца для переливания крови ёмкостью 200-250 мл (АзНИИРХ). Наконечник из пластмассы или толстой оплавленной стеклянной трубки, соединённый гибким шлангом со шприцем, вводят в генитальное отверстие самца. Движением поршня создаётся вакуум, и сперма всасывается в цилиндр. Такой способ получения спермы обеспечивает стерильность операции и позволяет отбирать необходимое в данный момент количество спермы [1].
Сперма часто созревает отдельными порциями, поэтому её можно брать от самцов несколько раз. Для этого самцов после каждого отцеживания сажают в специальные садки для выдерживания, при котором созревает очередная порция спермы.
Так же сперму, если нужно, можно получить заранее. Для этого её отцеживают в сухую стеклянную посуду, лучше в пробирку, и сохраняют в термосе на льду при температуре около 1-2°C в течение 1-2 суток.
После получения половых продуктов, определения их качества, учёта — осеменяют икру. От способа осеменения зависит эффективность оплодотворения икры. Икру осеменяют смесью спермы от 3-5 самцов, что обеспечивает высококачественное оплодотворение. Обычно осеменение производят не позднее чем через 10-20 минут после взятия икры, так как задержка может привести к ухудшению её качества.
Для белорыбицы используют сухой способ осеменения. В таз отцеживают 3-4 кг икры, затем на икру выливают из пробирки сперму от 3-5 самцов из расчёта 2-2,5 мл спермы на 1 кг икры. Половые продукты осторожно и тщательно перемешивают рукой. Затем добавляют около 100 мл воды на 1 кг икры, вновь перемешивают и оставляют на 3-5 минут.
Инкубация икры
Инкубируют икру в аппаратах Вейса. Аппарат представляет собой стеклянный или из органического стекла сосуд, суживающийся книзу (перевёрнутая большая бутылка без дна). Верхние края сосуда обтянуты обручем из оцинкованного железа. Нижнее отверстие аппарата закрыто пробкой с ввёрнутой в центре металлической трубкой диаметром 0,8-1 см. Наружный конец этой трубки соединён резиновым шлангом, по которому поступает в аппарат вода из водопроводного крана. Чтобы не было мёртвого пространства над пробкой, у стенок сосуда, где отсутствует ток воды, это место заполняют воском или менделеевской замазкой. Пробке придают нужную вогнутую форму. Токи воды, идущие из водопроводного края, поступают под напором в нижнюю часть сосуда и поднимают вверх помещённую в аппарат икру. В верхней части сосуда напор воды ослабевает, поэтому икринки начинают постепенно опускаться в нижнюю часть его, где подхватываются струями воды и вновь увлекаются вверх. Так на протяжении всего периода инкубации икра находится в непрерывном движении в толще воды. Сброс воды из аппарата происходит через сливной носик, сделанный в железном обруче, обтягивающем верхние края сосуда [1].
Аппарат Вейса устанавливают в стойке, имеющей два гнезда, одно из которых удерживает нижнюю часть, а другое — среднюю часть сосуда. Причём аппарат должен стоять обязательно в строго вертикальном положении. В противном случае струи воды будут направляться по одной стороне сосуда, что может вызвать неравномерное вращение икринок и заморы в отдельных частях аппарата. Аппараты Вейса обычно монтируют по 10-40 шт. на одной стойке, причём для каждого из них обязательно независимое водоснабжение. Сброс воды из аппаратов осуществляется первоначально в общий водосбросной лоток, лежащий под стойкой, а из него в канализационную сеть. Для задержки икры в момент отключения водоподачи используют обратный клапан. Расход воды в аппарате 2-4 л/мин (рис. 21) [1].
1 – стеклянный сосуд; 2 – металлическая трубка; 3 – пробка; 4 – водоподающий шланг.
Рисунок 21 – Инкубационный аппарат Вейса [1]
При получении икры, осеменении, отмывке и инкубации желательно не смешивать икру от разных самок, так как при разном качестве икры выход предличинок из икры лучшего качества при смешивании будет ниже из-за развития сапролегнии.
Кроме того, при определении количества икры, которое нужно загружать в один аппарат, необходимо вносить поправку на число эмбрионов в 1 г, так как потребление кислорода и интенсивность обменных процессов определяется не только общей массой икры, но и её количеством. Другими словами, закладывать икру в инкубационный аппарат нужно исходя из количества, а не из её массы. Норма загрузки икры в инкубационные аппараты 200 тыс. штук. Перегрузка аппаратов икрой влечёт за собой отставание в развитии, повышает процент уродов и увеличивает отход [1].
Инкубация икры в аппаратах Вейса должна проходить при температуре воды от 0,1 до 3 °C. Продолжительность развития эмбрионов в аппарате около 5 месяцев. Выклев предличинок происходит в первой половине апреля при температуре 4-6 °C. Освещение во время инкубации ограничивается, так как является губительным для эмбрионов. Отход за период инкубации не должен превышать 10 % [2].
Уход за икрой в период инкубации заключается в наблюдении за температурой, концентрацией кислорода, диоксида углерода, pH, проточностью, уровнем воды, световым режимом, состоянием эмбрионов: отбор мёртвых эмбрионов (специальным пинцетом, грохотками, грушами, сифоном), профилактической обработке по мере необходимости. Мёртвые икринки отличаются беловатым цветом. Отбор мёртвых эмбрионов, нужно проводить в периоды пониженной чувствительности [1].
Для повышения жизнестойкости рыб в раннем онтогенезе используют нейропептиды. Таким нейропептидом является — даларгин. В настоящее время в России он производиться промышленностью, и легкодоступен. Этот пептид повышает выживаемость икры, предличинок, личинок и молоди рыб, ускоряет темп роста, что приводит к увеличению прироста ихтиомассы выращиваемой рыбы, снижению затрат кормов, себестоимости рыбы. Воздействие даларгина в раннем эмбриогенезе увеличивает выживаемость эмбрионов и личинок на 10-69 %.
Так же используется низкоинтенсивное лазерное излучение, которое позволяет повысить эффективность инкубации икры. Лазерное излучение, также как и синтетические нейропептиды, пример многофункционального экзогенного регулятора. Воздействие лазера на сиговых и других рыб приводит к ускорению и синхронизации эмбриогенеза, стимуляции роста эмбрионов, увеличению их выживаемости, снижению доли аномальных предличинок после облучения неоплодотворённой икры, предотвращению развития сапролегниоза. Так, например, масса тела эмбрионов увеличивается на 13-38 %, их длина — на 3—8 %, уменьшается продолжительность вылупления в 2,0-2,5 раза, повышается выживаемость в 2-3 раза. Наиболее эффективное положительное действие оказывает красное излучение гелий-неонового лазера (632 нм) по сравнению с синим, зелёным и ультрафиолетовым [1].
Инкубация икры в аппаратах Вейса при температуре 0,5-6,5 °C составит 195-120 дней [1].
Рисунок 22 – Инкубационный цех [2]
Выдерживание предличинок
Вылупление предличинок происходит в первой половине апреля, при температуре 4-6 °C и продолжается несколько суток. Предличинки белорыбицы имеют жировую каплю в небольшом желточном мешке. У них хорошо развиты грудные плавники. Держатся предличинки в стае, не боятся света. Вылупившиеся предличинки из аппаратов Вейса с током воды попадают в жёлоб и переносятся в сетчатые садки-питомники, установленные в бассейнах для выдерживания производителей. Предличинок выдерживают в садках при плотности посадки от 150 до 200 тыс. шт. Через 3—4 дня предличинки становятся личинками, которые переходят на смешанное питание [2].
stydopedia.ru
Способ перемешивания икры рыб в процессе ее инкубации в аппаратах вейса
№ 131586
Класс 4511, 24о1
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Подписная группа ¹ 188
А.,В. Кузнецов
СПОСОБ ПЕРЕМЕШИВАНИЯ ИКРЫ РЫБ В ПРОЦЕССЕ ЕЕ
ИНКУБАЦИИ В АППАРАТАХ «ВЕЙСА»
Заявлено 20 января 1960 г. за № 661293/28 в Комитет по делам изобретений и открытий при Совете Министров СССР
Опубликовано в «Бюллетене изобретений» № 17 за 1960 г.
Известны способы перемешивания икры рыб в аппаратах «Вейса» .в период ее инкубации, осуществляемые с помощью деревянных мешалок.
Описываемый способ отличается от известных тем, что перемешивание икры осуществляется гидравлическим путем и состоит в том, что к внутренней поверхности аппарата подводится, например, при помощи стеклянной трубки с резиновым наконечником струя воды в несколько приемов, чем достигается быстрое и качественное перемешивание икры и исключаются механическое воздействие на икру и ее потери.
На чертеже изображена схема гидравлического перемешивания икры в аппарате «Вейса».
Над водопадающим верхним лотком 1 на высоте около 200 мм от уровня воды в лотке крепится трос (проволока) 2, на котором установлен передвигающийся держатель 3 для шланга-сифона 4 с внутренним диаметром 14 — 16 »1м. В длинный конец шланга-сифона вставляется стеклянная трубка 5 с резиновым наконечником б. К держателю 8 крепится рычаг 7 для передвижки шланга-сифона 4 по поддерживающему тросу 2.
Процесс перемешивания икры осуществляется следующим образом.
Зажимается шланг 8 зажимом Гофмана 9 (или рукой), чем прерывается поступление воды снизу в аппарат «Вейса» 10 и одновременно погружается наконсчник стеклянной трубки 5 в воду над уровнем икры. На этом уровне обводят наконечником и омывают выходящей из него струей воды внутреннюю поверхность аппарата по всему периметру, очищая внутреннюю стенку аппарата от прилипшей икры, затем наконечник погружают на тлубину действия предыдущей струи воды и повторяют тот же прием.
Так действуют до тех пор, пока не достигнут основания аппарата, при этом вся масса икры перемешивается. № 131586
Предмет изобретения
Способ перемешивания икры рыб в процессе ее инкубации в аппаратах «Вейса», отл и ч а ю щи йся тем, что, с целью более качественного перемешивания и устранения при этом механических повреждений и потерь икры, перемешивание производят струей воды путем воздействия ею на внутреннюю поверхность инкубационного аппарата, причем струю воды вначале подводят к стенке аппарата непосредственно над уровнем икры в нем и на этом уровне омывают внутреннюю поверхность аппарата по всему периметру, а затем повторяют этот прием, последовательно опуская струю воды в слой икры на глубину предыдущего действия струи.
Редактор В. В. Хазова Техред А. А. Камышникова Корректор Б. А. Шнейдерман
Поди. к печ. 2.Х1-60 г. Формат бум. 70 (108 />6 Объем 0,17 п. л.
Зак. 8973 Тираж 650 Цена 25 коп.; с 1.1-61 r. — 3 коп.
ЦБТИ при Комитете по делам изооретений и открытий при Совете Министров СССР
Москва, Центр, М. Черкасский пер., д. 2/6
Типография ЦБТИ Комитета по делам изобретений и открытий при Совете Министров СССР, Москва, Петровка, 14.
www.findpatent.ru
Инкубатор для икры малавийских цихлид своими руками
Как происходил процесс создания инкубатора для икры? Решив попробовать свои силы в содержании и разведении инкубирующих цихлид из озера Малави, я столкнулся с необходимостью искусственной инкубации икры цихлид. Дело в том, что выращенные в условиях неволи самки в значительной степени утратили родительский инстинкт.
Поносив икру во рту несколько дней, нерадивые мамаши не выдерживают бремени забот и проглатывают ее. Правда, иногда происходит и обратное – рыба «передерживает» потомство и выпускает в конце концов истощенных «затянутых» мальков, которые впоследствии не порадуют аквариумиста здоровым видом и хорошим ростом.
Фото цихлиды Малави
Но даже если все прошло более-менее удачно, мальки, появившиеся на свет в общем аквариуме, обычно немедленно съедаются остальными рыбами. Отсаживать же самку с икрой в отдельную емкость далеко не всегда возможно или целесообразно: для того, чтобы довольно крупная рыба (длина самых мелких малавийцев превышает 8-10 см) комфортно прожила примерно три недели, требуется свободный водоем литров эдак на двадцать-сорок. А если таких самок много?
Не последнюю роль для разводчика играет и тот факт, что самка, у которой «отнимают» икру, нерестится гораздо чаще. Таким образом, серьезные аквариумисты предпочитают инкубировать икру эндемиков озер Малави и Танганьика искусственно.
Для этого, естественно, понадобится инкубатор для цихлид. Со второй попытки мне удалось сделать из тонкого оргстекла более-менее сносно работающий инкубатор по традиционной схеме (описание которой, кстати говоря, не появлялось в аквариумной литературе уже лет пятнадцать). Принцип его функционирования заключается в том, что икринки находятся между двумя стенками, образующими направленный вниз угол, при этом в основании угла имеется узкая щель, сквозь которую тем или иным способом обеспечивается ток воды. При сборке этой конструкции я столкнулся с рядом проблем. Самая значимая заключалась в том, что в домашних условиях трудно раскроить и склеить детали инкубатора таким образом, чтобы щель между наклонными стенками имела равную ширину.
Малейший перекос приводит к «залипанию» и скучиванию икринок в той части секции, где щель уже.
Конструкция получается громоздкой, особенно если в ней предусмотрено несколько секций для изолированной инкубации икры нескольких самок (в изделиях подобного типа перегородки между секциями, как правило,вклеивают «наглухо»). Я попробовал сделать перегородки съемными, чтобы можно было произвольно регулировать ширину и количество секций, но мне не удалось идеально подогнать торцы перегородок к основным стенкам и это привело к «залипанию» икринок на щели между стенкой и перегородкой.
Видео инкубация икры малавийских цихлид
В таком инкубаторе проток воды сквозь все ячейки одинаков, и регулировать турбодинамический режим в отдельно взятой ячейке не представляется возможным, в то время как зачастую это бывает необходимо. В процессе инкубации по мере развития эмбриона икринка значительно «теряет в весе» и интенсивность тока воды должна постепенно ослабляться. Кроме того, икра крупных и мелких видов цихлид различается по размеру и весу. Это также может привести к проблемам при одновременной инкубации.
Дав свободу инженерной мысли, я сконструировал и с успехом эксплуатирую инкубатор для икры, лишенный перечисленных выше недостатков. Он исключительно компактен и легок в изготовлении, при этом необходимые материалы недефицитны и вполне доступны по цене.
Конструкция инкубатора для икры цихлид
Конструкция инкубатора для икры цихлид изготавливается из следующих деталей: поплавок (5); корпусы шприцев (6) в необходимом количестве; «флейта» – трубка с отверстиями для шлангов (4); винтовые зажимы для шлангов (10): сами шланги; сетчатая тюлевая или капроновая ткань с размером ячеек не более 1,0×1.0 мм (9): «муфты» из эластичного, желательно прозрачного, шланга (7), плотно надевающиеся на корпусы шприцев; небольшой отрезок шланга (8) соответствующего диаметра, подающий воду из помпы (2) во «флейту» (3).
Корпусы шприцев следует переделать следующим образом. Патрубок для иглы нужно запаять. Для этого примерно половина его отрезается острым ножом или кусачками, затем оставшаяся часть нагретым на огне толстым гвоздем с легкостью запаивается и выравнивается «заподлицо» с торцом шприца. Теперь нагретым на огне тонким гвоздем или иглой прожигаются отверстия в верхней части шприца, начиная от отметки 15 мл и до самого верха. Чем больше будет дырочек, и чем меньше их диаметр — тем лучше – это исключит «запинание» икринок на отверстиях.
Далее толстым гвоздем в нижней (торцевой) части шприца строго по центру прожигается отверстие для резинового шланга. Затем острым ножом заготовку разрезают поперек на уровне отметки 7 мл (цифра 7 на шкале отсутствует, но не составляет труда сориентироваться по рискам между отметками 5 и 10 мл). Упоры для пальцев в верхней части шприца следует оставить – они понадобятся для фиксации шприца в отверстии поплавка.
Фото схема инкубатора для цихлид
Теперь можно сделать инкубационную ячейку, как показано на рис.3. Сначала муфту надевают на нижнюю часть заготовки, одновременно плотно натягивая сетку, затем присоединяют верхнюю часть.
Поплавок можно изготовить из плотного пенопласта. Я использую куски пенопластовых плинтусов, срезав острым ножом все лишнее.
Рекомендуемая толщина поплавка — 1 см, ширина – 5-7 см, длина выбирается в соответствии с количеством устанавливаемых шприцев-ячеек. Диаметр отверстий в поплавке должен обеспечивать свободную установку шприца с надетой на него муфтой. В зависимости от плотности используемого для поплавка материала отверстия можно делать при помощи перфоратора, сверла и затем доводить до необходимого диаметра округлым надфилем. Я просто «прокрутил» отверстия разрезанным поперек шприцем и затем расширил их надфилем.
«Флейта» изготавливается из пластмассовой трубки, один из концов которой наглухо закупоривается пробкой (11), а в другом тем или иным способом обеспечивается герметичное крепление водоподающего отрезка шланга от помпы (это можно сделать силиконовым герметиком).
Я изготовил «флейту» из тех же корпусов от шприцев, срезав но необходимости лишние части и спаяв одну длинную трубку. «Донышки» шприцев с запаянными патрубками становятся при этом торцами «флейты». Отверстия для шлангов во «флейте» выполняются с таким расчетом, чтобы вся конструкция шланг – шприц находилась в строго вертикальном положении. Малейший перекос здесь недопустим. Удобнее всего просто наложить поплавок с готовыми отверстиями во «флейту» и разметить отверстия во «флейте» строго по центру отверстий в поплавке.
Инкубация икры малавийских цихлид
Как происходил процесс создания инкубатора для икры? Решив попробовать свои силы в содержании и разведении инкубирующих цихлид из озера Малави, я столкнулся с необходимостью искусственной инкубации икры цихлид. Дело в том, что выращенные в условиях неволи самки в значительной степени утратили родительский инстинкт.
Поносив икру во рту несколько дней, нерадивые мамаши не выдерживают бремени забот и проглатывают ее. Правда, иногда происходит и обратное — рыба «передерживает» потомство и выпускает в конце концов истощенных «затянутых» мальков, которые впоследствии не порадуют аквариумиста здоровым видом и хорошим ростом.
Фото цихлиды Малави
Но даже если все прошло более-менее удачно, мальки, появившиеся на свет в общем аквариуме, обычно немедленно съедаются остальными рыбами. Отсаживать же самку с икрой в отдельную емкость далеко не всегда возможно или целесообразно: для того, чтобы довольно крупная рыба (длина самых мелких малавийцев превышает 8-10 см) комфортно прожила примерно три недели, требуется свободный водоем литров эдак на двадцать-сорок. А если таких самок много?
Не последнюю роль для разводчика играет и тот факт, что самка, у которой «отнимают» икру, нерестится гораздо чаще. Таким образом, серьезные аквариумисты предпочитают инкубировать икру эндемиков озер Малави и Танганьика искусственно.
Для этого, естественно, понадобится инкубатор для цихлид. Со второй попытки мне удалось сделать из тонкого оргстекла более-менее сносно работающий инкубатор по традиционной схеме (описание которой, кстати говоря, не появлялось в аквариумной литературе уже лет пятнадцать). Принцип его функционирования заключается в том, что икринки находятся между двумя стенками, образующими направленный вниз угол, при этом в основании угла имеется узкая щель, сквозь которую тем или иным способом обеспечивается ток воды. При сборке этой конструкции я столкнулся с рядом проблем. Самая значимая заключалась в том, что в домашних условиях трудно раскроить и склеить детали инкубатора таким образом, чтобы щель между наклонными стенками имела равную ширину.
Малейший перекос приводит к «залипанию» и скучиванию икринок в той части секции, где щель уже.
Конструкция получается громоздкой, особенно если в ней предусмотрено несколько секций для изолированной инкубации икры нескольких самок (в изделиях подобного типа перегородки между секциями, как правило,вклеивают «наглухо»). Я попробовал сделать перегородки съемными, чтобы можно было произвольно регулировать ширину и количество секций, но мне не удалось идеально подогнать торцы перегородок к основным стенкам и это привело к «залипанию» икринок на щели между стенкой и перегородкой.
Видео инкубация икры малавийских цихлид
В таком инкубаторе проток воды сквозь все ячейки одинаков, и регулировать турбодинамический режим в отдельно взятой ячейке не представляется возможным, в то время как зачастую это бывает необходимо. В процессе инкубации по мере развития эмбриона икринка значительно «теряет в весе» и интенсивность тока воды должна постепенно ослабляться. Кроме того, икра крупных и мелких видов цихлид различается по размеру и весу. Это также может привести к проблемам при одновременной инкубации.
Как сделать инкубатор для икры из пластиковой бутылки
Для того чтобы собрать самодельную конструкцию инкубатора, понадобятся две пластиковые бутылки. Их объем может быть любым, он зависит от размера аквариума и количества икры.
С бутылок обязательно нужно снять этикетки. Бутылки очищают от клея ацетоном и хорошо промывают.
После очистки от клея бутылки разрезают на две части. Для инкубатора используют только верхние части бутылок с горлышками. В одной из крышек просверливают отверстие. Его можно вырезать с помощью острого канцелярского ножа.
Затем крышки бутылок откручивают, а в горлышки помещают мелкую сетку. В качестве сетки можно использовать кусочек старой тюли или материал от аквариумного сачка. Крышки закручивают обратно.
Далее бутылки соединяют друг с другом широкой стороной и закрепляют с помощью скотча. Инкубатор закрепляют с помощью присоски с внутренней стороны аквариума. В самодельный инкубатор для икры устанавливают иглу для капельницы с трубкой, которую подключают к компрессору.
Принцип работы самодельного инкубатора для икры
С помощью компрессора инкубатор наполняется водой, которая будет постоянно обновляться. Икру собирают вручную «грушей» и помещают в инкубатор. Из-за сетки в емкость с икрой не смогут заплыть взрослые рыбы. Так как бутылки прозрачные, вы сможете наблюдать за развитием икры.
Когда вылупятся мальки, нужно будет опустошить инкубатор вручную. Внутри пластиковых бутылок можно установить перегородку. Таким образом, вы получите два отделения, дно из которых используют для развития икры, а второе – для роста мальков.
При использовании самодельного инкубатора для икры вы сможете заниматься разведением аквариумных рыбок.
В стремлении оптимизировать процесс разведения африканских цихлид аквариумисты часто прибегают к помощи инкубаторов. Самки, как правило, на протяжении месяца вынашивают икру во рту, что приводит к их истощению и неспособности вступать в новый нерест. Это не может устраивать разводчика, который вытряхивает кладку и помещает икринки на созревание в специально созданный резервуар. В данной статье речь пойдет о простейшем самодельном инкубаторе для африканских цихлид, представляющий из себя усовершенствованную версию известной ранее модели.
Представленная схема инкубатора неэффективна. Подробности смотрите в комментариях
Основные требования, которым должен отвечать инкубатор следующие:
1. Непрерывная протока в емкости с икринками. В инкубатор должна поступать чистая аэрируемая вода, по гидрохимическим показателям аналогичная аквариумной.
2. Отсутствие острых граней, о которые икринки и личинки могут повредиться и областей, где они могут застрять. Кладка должна находится в непрерывном циркулирующем состоянии.
3. Нельзя допускать скучивание кладки. В противном случае наступает гипоксия, и, кроме того, грибок от умершей икры будет переходить на здоровую.
Корпус самодельного инкубатора представляет собой 1,5 литровую бутылку со срезанным дном. В горлышко вставлен обрезок от 20-мл шприца, который включает срезанный поршень и распылитель. Верхняя часть инкубатора слегка выступает над поверхностью воды, чуть ниже перфорирована для оттока. Бутылка крепится в стенкам аквариума при помощи двух присосок.
Обрезок 20 мл шприца плотно вставлен в горлышко. Внутри его корпуса находится наклоненное дно инкубатора, которое представляет из себя обрезок поршня. Поверхность шприца и поршня гладкие, что исключает повреждение икринок. На всякий случай можно немного оплавить их края. Наклон дна приводит к скатыванию опускающихся икринок к прорези, из которой происходит приток воды и аэрация.
В инкубаторе нет мёртвых пространств и вся кладка перемешивается.
Красным обозначена область обточки распылителя. Данное пространство будет пропускать воздух и воду в инкубатор.

Красным обозначена область обточки поршня. Снизу будет подходить распылитель.

Общий вид на нижнюю часть инкубатора.
Нежелательно отбирать у самок африканских цихлид икру сразу после нереста. Рекомендуется подождать 3-5 суток.
(0 голосов, среднее: 0 из 5)
Поделитесь с друзьями!
Инкубация Артемии
Для инкубации цист артемии используют конусовидные сосуды вместимостью 200 литров (можно и меньше, конечно). Высокое содержание кислорода и перемешивание яиц в аппарате осуществляется путем аэрации воды с помощью компрессора, распылители которого устанавливаются в донной части аппарата. Над аппаратами обеспечивается постоянное интенсивное искусственное освещение. Для инкубации активированные яйца артемии помещают в 4–5%-ный раствор поваренной соли (NaCl). Плотность закладки яиц зависит от их качества и размера и составляет в среднем 4–5 г/л. В инкубационном аппарате необходимо поддерживать температуру 27–29 °С, рН 7,5–8,5. При этих условиях выклев науплий происходит через 24–30 ч после закладки яиц.

По завершении инкубации на 15 мин выключается свет и компрессор. В результате оболочки всплывают вверх, а науплии концентрируются в нижней части аппарата. После этого через сливной кран сначала сливаются мертвые и непроклюнувшиеся цисты (скапливающиеся в нижней конической части), а затем в мешок из газ-сита (114 мкм) сливают науплий. Полученных науплий либо сразу скармливают, либо помещают в бассейны с 3–5%-ным раствором соли для дальнейшего подращивания, либо замораживают.
Рекомендуется проводить предварительную обработку (активацию и декапсуляцию) яиц артемии перед их инкубацией. Яйца артемии покрыты хитиновой оболочкой, которая значительно снижает процент выхода рачков из яиц при инкубации. Кроме того, необходимо будет отделять выклюнувшихся науплий от мертвых яиц и пустых оболочек, что может быть не так просто. Декапсулированные эмбрионы более калорийны и энергичны, так как они не расходуют энергию на разрыв хитиновой оболочки. А успешно проведенная декапсуляция иногда позволяет обойтись вообще без инкубации яиц.
Активация способствует прерыванию диапаузы яиц и повышению процента выхода личинок (стоит отметить, что у яиц, продающихся в магазинах в товарной упаковке, этот процесс уже прерван). Она напоминает им холодную зиму, после которой они быстрее выйдут из своей скорлупы, а также дадут лучший процент «всхожести».

Существуют следующие способы активации яиц артемии:
1. Сухие яйца кладутся в раствор поваренной пищевой или аптечной морской соли (35–47 г/л) и промораживаются при температуре –15–20 ºС в течение одной-двух недель, затем в раствор бросают таблетку гидроперита, далее через 20–30 мин яйца промывают под краном водопроводной водой (5–10 с).
2. Сухие яйца кладутся в раствор поваренной пищевой или аптечной морской соли (35–47 г/л) и промораживаются при температуре –25 ºС в течение 1–2 мес.
3. Сухие яйца кладутся на 30 мин в 3%-ный раствор перекиси водорода (50 г яиц на 1 л раствора), промываются и кладутся в инкубатор. Это лучший способ активации при отсутствии морозильника.
4. Сухие яйца кладутся на 2 ч в пресную воду, имеющую температуру 25–30 ºС, далее отцеживаются и помещаются на сутки в раствор поваренной пищевой или аптечной морской соли (35–47 г/л). Данная операция повторяется три раза.
5. Если нет возможности проморозить яйца при температуре –25 ºС, то можно положить их в морозильник в солевом растворе, приготовление которого описано выше, на срок от одного дня до двух месяцев перед инкубацией.
При кормлении артемией рыб, планируемых на нерест, лучше всего подойдет второй вариант, с промораживанием не менее двух месяцев. После активации в морозильнике яйцам дают 3–4 дня отстояться при комнатной температуре перед инкубацией.

Методика декапсуляции цист артемии
Для улучшения технологии выклева артемии используют декапсуляцию. Метод декапсуляции цист артемии изначально применялся только для исследовательских целей, а позднее был широко внедрен в промышленную аквакультуру. Рыбоводами-практиками по достоинству была оценена возможность массового получения лишенных оболочек цист артемии в качестве стартового корма, обладающего отличными биохимическими характеристиками.
Декапсуляция – растворение хориона при сохранении живого зародыша – технологический прием, который может дать сильный импульс продвижению хозяйственного освоения артемии, поскольку эта операция резко улучшает показатели использования цист: делает излишним отделение науплий от скорлупы и неразвившихся цист, повышает «всхожесть» цист, жизнестойкость и энергетическую ценность науплий, дает гарантию от привнесения с кормом болезнетворного начала и др.

Декапсуляция цист, выполненная перед инкубацией, имеет несомненные достоинства получения науплий из нативных цист. Объясняется это тем, что неразвившиеся цисты и скорлупу очень трудно отделить от живых науплий. Будучи же заглоченными, они могут стать причиной закупорки кишечника личинок. Особенно часто это встречается у молоди стерляди и других видов, чьи личинки отличаются мелкими размерами. Кроме того, на внешней поверхности скорлупы иногда встречаются споры бактерий и растений, что также может быть небезопасным.
Из цист, лишенных скорлупы, вылупляются науплии, обладающие большим запасом энергии, поскольку последняя не расходуется на работу по разрыву скорлупы и выходу из нее.
Применение декапсулированных цист непосредственно в качестве стартового корма имеет следующие преимущества: отпадает необходимость в инкубации, следовательно, не нужны инкубационные аппараты и среды, специальные помещения, системы обогрева, подачи сжатого воздуха. Исключается или резко сокращается расход электроэнергии. Не требуется отделять корм от скорлупы и неразвившихся цист. Процесс сокращается с 48 ч до 20 мин. Устраняется зависимость производства от крайне непостоянного показателя – величины «всхожести» цист: практически все цисты используются как стартовый корм. Устраняется опасность занесения с кормом болезней рыб.
Применение метода декапсуляции заключается в следующем: сухие яйца необходимо в течение часа подержать в пресной воде, а затем поместить в следующий раствор: 50 г гипохлорита кальция и 16 г кальцинированной соды на 1 л воды. Данные вещества тщательно перемешиваются в течение 1–1,5 мин и отстаиваются, затем сливается осадок. Соотношение объемов яиц и раствора должно быть 1:10.
В целом, для декапсулирования яиц подойдут препараты, содержащие активный хлор: диоксид хлора, гипохлорит натрия, гипохлорит кальция, хлорная (белильная) известь (оптимальная концентрация активного хлора в растворе 17 г/л при температуре около 20 °С). Примерная концентрация этих веществ в растворе должна быть следующей: гипохлорит кальция – 3 %, хлорная известь – 6 %, гипохлорит натрия – 9 %. Но необходимо соблюдать осторожность: декапсулирующий раствор – это едкая жидкость, которая может разъесть кожу рук, также она не должна попадать в глаза, рот, нос.
Декапсуляция длится до часа (обычно не более получаса): раствор с яйцами постоянно перемешивается вручную или посредством пузырьков от компрессора (яйца должны быть постоянно в движении).
По мере своего разрушения оболочки яиц приобретают оранжевый цвет. Декапсулированные яйца могут сразу же скармливаться малькам, необходимо лишь промыть их в течение 8–10 мин проточной теплой водой. В сачках применяются только капроновые материалы (шелк разъедается хлором), емкости должны быть стойкими к коррозии.
Декапсулированные яйца хорошо хранятся в холодильнике, в плотно закрытой банке. Рекомендуется перед скармливанием замочить их в воде на 15–20 мин или залить горячей водой на 3–5 мин. Если же необходимо «законсервировать» продукт, то его хранят в насыщенном солевом растворе в течение нескольких месяцев, а по мере необходимости инкубируют или скармливают. В таком растворе личинки рачков обезвоживаются и у них приостанавливаются процессы жизнедеятельности. Для того чтобы вернуть их в нормальное состояние, необходимо положить эмбрионов в раствор с соленостью менее 80 ‰.
Источник