В этом сезоне:
- Модный словарь
18+

Justin Ripper, автор JustLady.
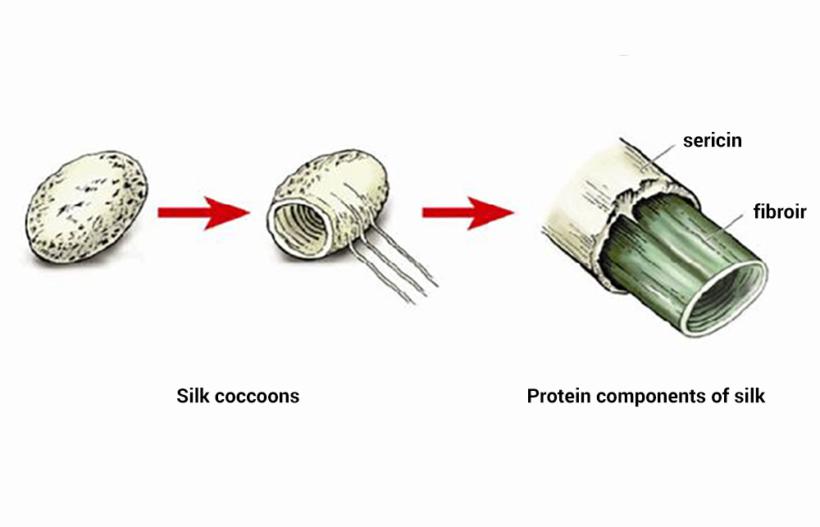
Фиброин – белок, который является основным компонентом натурального шелкового волокна. Само волокно при помощи двух шелкоотделительных желез выделяют дубовый, тутовый шелкопряд или другие виды насекомых. Фиброин является, по сути, вязкой жидкостью, которая затвердевает в воздухе, превращаясь в нерастворимую нить. Так как железы две, то и нитей получается две. Они крепятся…
Фиброин – белок, который является основным компонентом натурального шелкового волокна. Само волокно при помощи двух шелкоотделительных желез выделяют дубовый, тутовый шелкопряд или другие виды насекомых. Фиброин является, по сути, вязкой жидкостью, которая затвердевает в воздухе, превращаясь в нерастворимую нить. Так как железы две, то и нитей получается две. Они крепятся между собой другим белком, серицином, и в результате получается шелковая коконная нить.
Фиброин — Версия для печати
добавлена 20 марта 2020 в 19:11
добавлена 11 декабря 2019 в 08:29
добавлена 16 сентября 2015 в 13:31
Принимаем заказы!
Добрый день, дорогие друзья.
В этой теме мы принимаем заявки на заказы, которые вы по той или иной причине не хотите (или не можете) оформить на нашем сайте.
Для отправки заказа оставьте комментарий с интересующими вас продуктами, после чего с вами через личные сообщения свяжется менеджер и оформит заказ.
Будем рады видеть всех среди покупателей нашего магазина.
добавлена 15 сентября 2015 в 20:25
Отзывы о работе интернет-магазина.
Добрый день, дорогие друзья!
Мы будем рады услышать в этой теме все о себе — как хорошее, так и плохое.
Есть совет, что нам нужно улучшить?
У вас возникли проблемы при оформлении заказа?
Все хорошо и вам все понравилось?
Мы — ужасный магазин?
Мы — лучший магазин в мире?
В любом случае — нам важно знать ваше мнение!
Также, будет отлично, если вы оставите отзыв на понравившиеся вам продукты у нас на сайте или напишите отзыв о магазине на Яндекс.Маркете: m
#отзыв #мнение #работа
добавлена 15 сентября 2015 в 20:23
Вопросы по текущим заказам.
Добрый день, дорогие друзья!
В этой теме вы можете задавать вопросы, касающиеся уже оформленных заказов (на сайте или странице Контакте).
Обсуждаемые темы:
— Стоимость доставки уже оформленных заказов;
— Доставка заказов: вопросы по срокам, вариантам доставки и т. д.;
— Проблемы, связанные с текущей доставкой: курьер не позвонил, не пришло оповещение с почты, не позвонили из ПВЗ и т. д.;
— Проблемы, связанные с уже доставленными заказами: неполная посылка, испо
добавлена 31 марта 2020 в 15:35

Нетрадиционная медицина давно практикует такой метод как акупунктура, или иглоукалывание. Этому методу более 2 тысяч лет, он имеет очень много поклонников, которые отмечают его реальную пользу. В чем его суть и польза:
1. С помощью очень тонких игл, диаметром доли миллиметра и за раз в общей сложности в количестве не более десяти, активизируются естественные силы организма.
2. Акупунктурных точек миллионы — они представляют собой особые места
добавлена 30 марта 2020 в 20:35
добавлена 30 марта 2020 в 15:35
добавлена 29 марта 2020 в 15:35

Диодную эпиляцию можно назвать наиболее эффективным способом удаления волос на теле. И вот почему:
1. Диодная эпиляция — это инновационный метод, имеющий больше преимуществ, по сравнению с лазерной эпиляцией.
2. Для диодной эпиляции используется прибор под названием Light Sheer DUET. Его отличие от обычного лазера в том, что его волна проникает глубже в кожу и разрушает даже те волосяные луковицы, которые не может «достать» обычный лазер.
3. Процедура дает лучший результат
добавлена 28 марта 2020 в 20:35
добавлена 28 марта 2020 в 15:35
добавлена 27 марта 2020 в 15:40

#опрос #фраттиshop #фраттишоп
добавлена 27 марта 2020 в 15:35

Для лечения варикозного расширения вен сегодня во флебологии используется малоинвазивная методика или эндовазальная лазерная коагуляция. Что она из себя представляет?
1. Процедура выполняется в операционной, под строгим контролем ультразвукового аппарата. Специалист делает прокол вены и вводит радиальный световод. По мере его выведения происходит склеивание внутренней стенки сосудов. Происходит равномерный нагрев стенок без перегрева соседних тканей.
2. Перед процеду
добавлена 26 марта 2020 в 20:35


«Маска очень крутая, мне понравилось состояние волос после ее применения. Волосы на ощупь очень мягкие, гладкие и шелковистые. Маска отлично питает и увлажняет волосы делая их более блестящими и здоровыми. Она не утяжеляет и не жирнит волос. После нее волосы не путаются, легче расчесываются, не электризуются и не топорщатся в разны
добавлена 26 марта 2020 в 15:35
Автор работы: Пользователь скрыл имя, 03 Октября 2013 в 14:51, лекция
Описание работы
Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью . В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот.
Файлы: 1 файл
Цепь тропомиозина
- Фиброин – фибриллярный белок, выделяемый паукообразными и некоторыми насекомыми и составляющий основу нитей паутины и коконов насекомых, в частности шёлка тутового шелкопряда Bombyx mori.
Первичная структура фиброина
- Фиброин является гетеродимером, образованным двумя белковыми цепями — тяжелой массой 200-500 кДа (H-фиброин, от англ.
heavy) и легкой ~25 кДа (L-фиброин, от англ. light). Его первичная структура одинакова у H- и L-субъединиц и состоит из повторяющейся аминокислотной последовательности (Gly-Ser-Gly-Ala-Gly-Ala)n.
- В свою очередь, повторяющиеся аминокислотные последовательности образуют антипараллельные складчатые β-слои, связанные водородными связями. Эта структура обуславливает высокий предел прочности нитей паутин и шелка. Более прочный, чем кевлар, фиброин вдобавок ещё и высоко эластичен. Эти качества делают его материалом, применяемым в различных областях, включая биомедицину и текстильное производство.
- Фиброин может образовывать три типа структур, называемых шёлк I,
II и III. Шёлк I – натуральная форма фиброина, который выделяется из шёлкоотделительных желез тутового шелкопряда и присутствует в шелке-сырце. Шёлк II — структура фиброиновых молекул в крученой шёлковой пряже, его прочность выше, и он часто используется коммерчески в различных областях. Шёлк III – недавно открытая структура фиброина, впервые замеченная профессором Региной Валуцци (Regina Valluzzi) с помощниками в Тафтском Уиниверситете. Шёлк III формируется преимущественно в растворах фиброинов на поверхности раздела (то есть границе между водой и воздухом, поверхность раздела вода-нефть и т.д.). Исследование шёлка III для лучшего понимания его физической структуры, качеств и состава продолжается.
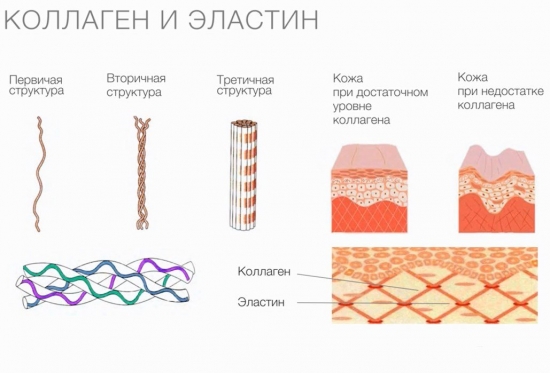
- Коллаге́н— фибриллярный белок, составляющий основу соединительной ткани организма (сухожилие, кость, хрящ, дерма и т. п.) и обеспечивающий её прочность и эластичность. Коллаген обнаружен у многоклеточных животных; отсутствует у растений, бактерий, вирусов, простейших и грибов. Это основной компонент соединительной ткани и самый распространённый белок у млекопитающих, составляющий от 25% до 35% белков во всём теле.
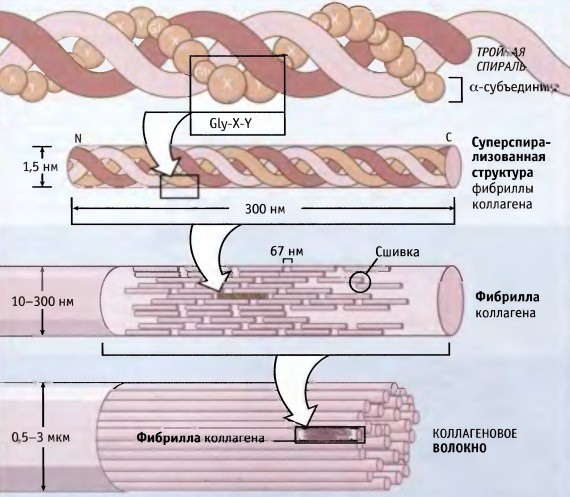
- Молекула коллагена представляет собой правозакрученную спираль из трёх α-цепей. Такое образование известно под названием тропоколлаген[3]. Один виток спирали α-цепи содержит три аминокислотных остатка. Молекулярная масса коллагена около 300 кДа, длина 300 нм, толщина 1,5 нм.
- Для первичной структуры белка характерно высокое содержание глицина, низкое содержание серосодержащих аминокислот и отсутствие триптофана. Коллаген относится к тем немногим белкам животного происхождения, которые содержат остатки нестандартных аминокислот: около 21
% от общего числа остатков приходится на 3-гидроксипролин,
4-гидроксипролин и 5-гидроксилизин[4]. Каждая из α-цепей состоит из триад аминокислот. В триадах третья аминокислота всегда глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трёх перечисленных[3].
- Коллаген существует в нескольких формах. Основная структура всех типов коллагена является схожей. Коллагеновые волокна образуются путём агрегации микрофибрилл, имеют розовый цвет при окраске гематоксилином и эозином и голубой или зелёный при различных треххромных окрасках, при импрегнации серебром окрашиваются в буро-жёлтый цвет.
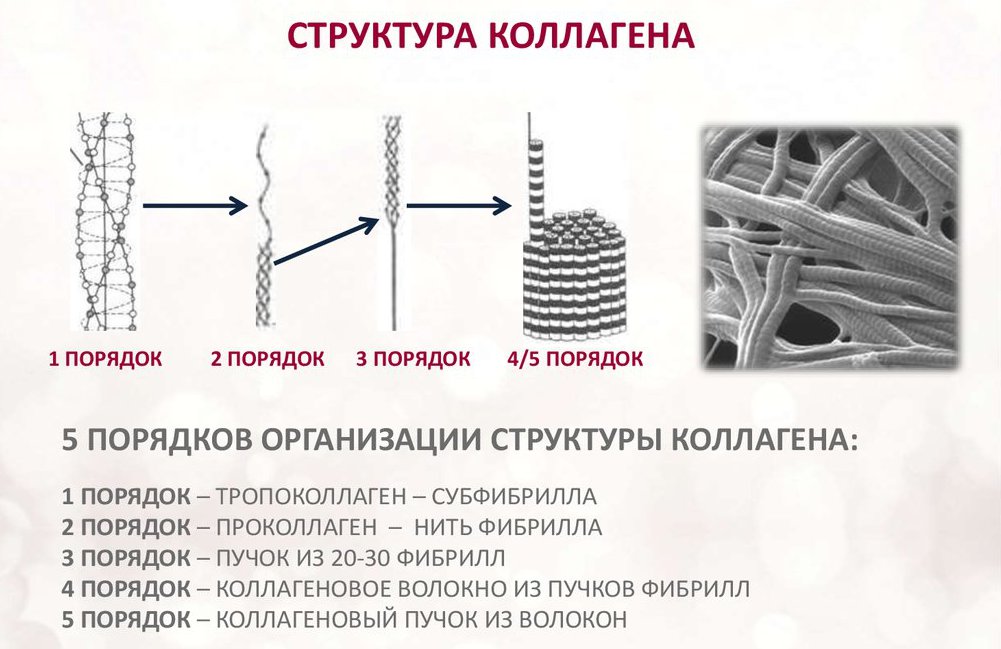
- Тропоколлагены (структурные единицы коллагена) спонтанно объединяются, прикрепляясь друг к другу смещенными на определённое расстояние концами, образуя в межклеточном веществе более крупные структуры. В фибриллярных коллагенах молекулы смещены относительно друг друга примерно на 67нм (единица, которая обозначается буквой «D» и меняется в зависимости от состояния гидратации вещества). В целом каждый D-период содержит четыре целых и часть пятой молекулы коллагена. Величина 300 нм, поделенная на 67 нм (300:67) не дают целого числа и длина молекулы коллагена разделена на непостоянные по величине отрезки D. Следовательно, в разрезе каждого повтора D-периода микрофибриллы есть часть, состоящая из пяти молекул, называемая «перекрытие», и часть, состоящая из четырёх молекул — «разрыв». Тропоколлагены к тому же скомпонованы в шестиугольную или псевдошестиугольную (в поперечном разрезе) конструкцию, в каждой области «перекрытия» и «разрыва».
- Внутри тропоколлагенов существует ковалентная связь между цепями, а также некоторое непостоянное количество данных связей между самими тропоколагеновыми спиралями, образующими хорошо организованные структуры (например, фибриллы). Более толстые пучки фибрилл формируются с помощью белков нескольких других классов, включая другие типы коллагенов, гликопротеины, протеогликаны, использующихся для формирования различных типов тканей из разных комбинаций одних и тех же основных белков. Нерастворимость коллагена была препятствием к изучению мономера коллагена, до того момента как было обнаружено, что возможно извлечь тропоколлаген молодого животного, поскольку он ещё не образовал сильных связей с другими субъединицами фибриллы. Тем не менее, усовершествование микроскопов и рентгеновских аппаратов облегчили исследования, появлялось все больше подробных изображений структуры молекулы коллагена. Эти поздние открытия очень важны для лучшего понимания того, как структура коллагена влияет на связи между клетками и межклеточным веществом, как ткани меняются во время роста и регенерации, как они меняются во время эмбрионального развития и при патологии.
- Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена. Коллагеновые волокна — это пучки фибрилл.
- Нарушения синтеза коллагена лежат в основе таких наследственных заболеваний, как дерматоспораксис у животных, латиризм (характерна разболтанность суставов, привычные вывихи), синдром Элерса-Данлоса (до 14 типов проявлений), несовершенный остеогенез (болезнь «стеклянного человека», врожденный рахит, врожденная ломкость костей), болезнь Марфана.
- Характерным проявлением этих заболеваний является повреждение связочного аппарата, хрящей, костной системы, наличие пороков сердечных клапанов.
- Болезни коллагена, в том числе так называемые коллагенозы, возникают из-за множества причин. Это может быть из-за мутации в гене, приводящей к изменению формы коллагеновой молекулы, или ошибки в пострансляционной модификации коллагена. Также болезни могут быть вызваны недостатком или «неправильной работой» ферментов, вовлеченных в биосинтез коллагена — дефицит ферментов гидроксилирования (пролин-, лизингидроксилазы), гликозилтрансфераз, N-проколлагеновой и С-проколлагеновой пептидаз, лизилоксидаз с последующим нарушением поперечных сшивок, дефицит меди, витаминов В6, C. При приобретённых болезнях, таких как цинга, восстановление баланса ферментов до нормального может привести к полному излечению.
- Практически любая генная мутация, ведет к утрате или изменению функций коллагена, что, в свою очередь, отражается на свойствах тканей и органов. Генные мутации в коллагеновом домене могут привести к изменению формы тройной спирали, путём вставки/делеции аминокислоты или замены Gly на другое основание. Мутации в неколлагеновых доменах могут привести к неправильной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведет к утрате функций. Мутантные a-цепи способны образовывать трех-спиральный комплекс с нормальными a-цепями. В большинстве случаев, такие комплексы не стабильны и быстро разрушаются, однако такая молекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в коллагеновых генах, являются доминантными.
- XuMuK.ru — КОЛЛАГЕН — Химическая энциклопедия
- Би-би-си | Наука и техника | Найдены мягкие ткани тираннозавра? — 25 марта 2005 г.
- Элементы — новости науки: Коллаген из костей динозавров — это уже реальность. — 20.04.07
- Финкельштейн А. В., Птицын О. Б. Физика белка. — Москва: КДУ,
2005. - Ленинджер А. Основы биохимии. — Мир,
1985. - Кератин / Словарь биотехнологических терминов
- Биохимия мышц и мяса: Учеб. пос.
/ В. В. Рогожин — СПб.: ГИОРД,
2006.
Информация о работе Особенности строения индивидуальных белков. Особенности строения доменных, фибриллярных белков и их биологическое значение

Белка – невероятно красивая попрыгушка из отряда грызунов известна абсолютно всем еще с самого раннего детства. Белки являются главными героинями многочисленных русских народных сказок и детских мультипликационных фильмов, о ней сочиняют стихи и придумывают загадки, разучивают песни и пословицы.
Сложно ответить на вопрос, почему именно белки так любимы и обожаемы всеми. Возможно из-за милой внешности и роскошного хвоста, а быть может благодаря своему активному поведению и интересным повадкам.
В любом случае, вашего ребенка важно познакомить с этим очаровательным зверьком. И новостной портал «Vtemu.by» в этой статье подготовил для Вас несколько не сложных фото мастер классов по изготовлению детских поделок белок. В качестве материалов в поделках будут использованы: пластилин, шишки, бумага, картонные рулоны от туалетной бумаги и т.д.
Белка поделка

Для изготовления такого забавного зверька, белки, Вам будет необходим картонный рулон от туалетной бумаги, цветная бумага, ножницы и клей.
Верхнюю часть картонного рулона необходимо сложить, чтобы получились ушки у будущей белочки.

Из цветной бумаги необходимо вырезать широкую длинную полоску и закрутить ее. Готовую полоску приклеить к картонной трубке – это будет хвост белки.

Из цветной бумаги так же вырежьте четыре лапки и мордочку. Приклейте все детали к картонной трубке. Не забудьте про носик и глазки.

Белочка из картонной втулки

Поделка Белочка своими руками — мастер класс
Белка из шишек поделка
Поделка белка из природного материала

Очень здорово смотрятся поделки из природного материала, а такая милашка белочка с пушистым хвостом в особенности.

Из пластилина вылепите тело, голову и лапки. Приклейте глазки и вылепите ушки. А хвост сделайте из большой шишки.
Белка поделка своими руками

Для изготовления таких милых бумажных белочек Вам будет необходим готовый шаблон (его мы прилагаем чуть ниже), цветные карандаши, ножницы и картонная трубка от туалетной бумаги.

Распечатайте готовый шаблон белки, аккуратно вырежьте все детали. Картонный рулон от туалетной бумаги разрежьте по диагонали, сделайте вертикальный надрез в самой высокой части.

Саму бумажную белку помещаем в сделанный разрез. По бокам картонной трубки приклеиваем лапки.

При необходимости разукрашиваем поделку карандашами.
Осенняя поделка Белка

И еще одна поделка и на этот раз объемная.

Распечатайте готовый шаблон, сложите по пунктирным линиям и разукрасьте. Объемная белка готова!

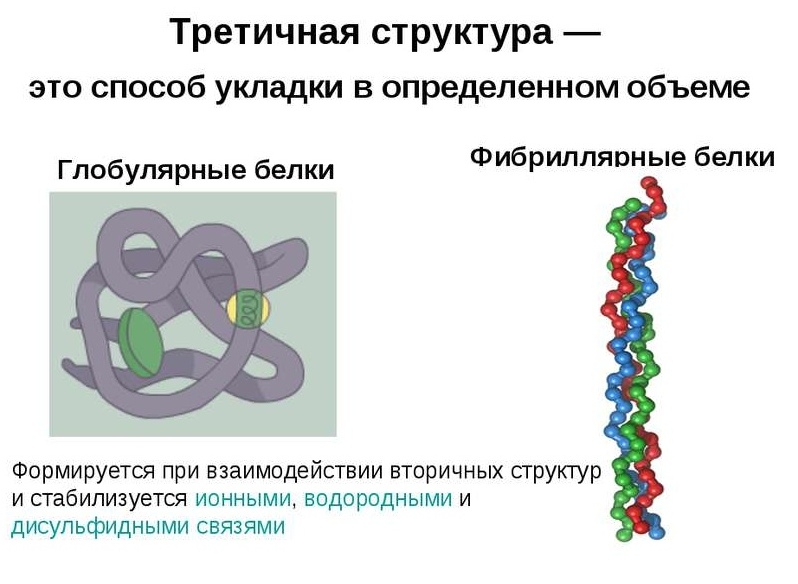
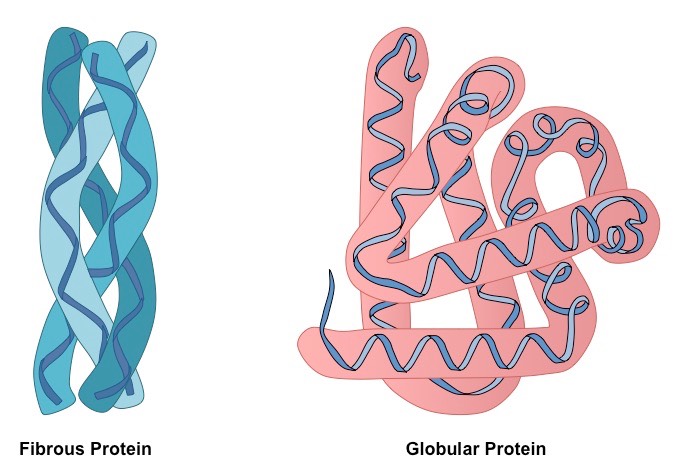
По особенности укладки в трехмерном пространстве различают две большие группы белков: глобулярные и фибриллярные. Большинство протеинов относится к первой фракции, которая соответствует типичной модели третичной структуры, описывающей аминокислотную цепь как сферический клубок с гидрофобным центром и гидрофильной поверхностью. Фибриллярные белки — это специфическая группа, характеризующаяся нитевидной формой молекул.
Общая характеристика пространственной структуры белка
В первоначальном виде синтезированный белок представляет собой линейную цепочку аминокислот, соединенных друг с другом пептидными связями. Однако на пути к конечной функциональной форме молекула претерпевает несколько стадий пространственной укладки за счет различных химических взаимодействий. Каждый этап формирования обозначен соответствующими структурами: первичной, вторичной, третичной и четвертичной (если имеется).
Глобулярные белки характеризуются трехмерной пространственной конформацией, которая удерживается комплексом слабых химических связей (водородные, ионные, гидрофобные и т. д.). По форме молекула такого протеина напоминает сферический клубок.
Полипептидные цепи фибриллярных белков формируют длинные волокна, которые состоят из повторяющихся элементов вторичной структуры. Устройство третичной конформации нитевидных протеинов по сравнению с глобулой значительно примитивнее, однако обеспечивает хорошую стабильность.
Основные отличия нитевидных белков от сферических
Кроме пространственной формы, фибриллярные белки отличаются от глобулярных по:
- размеру;
- растворимости;
- функциям.
Волокнистые протеины обычно крупнее сферических и представляют собой длинные стержни, сформированные из спиралей. В отличие от глобулярных белков, пространственная конформация фибриллярных обеспечивается за счет сильных водородных связей. По этой причине волокнистые протеины более стабильны и не так легко денатурируют, как сферические.
В отличие от глобулярных белков, фибриллярные:
- не растворяются в воде, а также слабых кислотах и основаниях;
- растворимы в сильных щелочах и кислотах;
- обладают свойствами растяжимости и сжатия;
- характеризуются высокой устойчивостью к пищеварительным ферментам.
Глобулярные белки построены из прямых участков вторичных структур, которые при соединении друг с другом резко меняют направление, формируя трехмерный клубок. Волокнистые протеины состоят из одного элемента, повторяющегося много раз.
Особенности фибриллярных протеинов
Разнообразие фибриллярных белков значительно меньше, чем глобулярных. Эта группа представляет собой специализированную фракцию протеинов, выполняющих преимущественно структурные функции. При этом фибриллярные белки работают на макроуровне, формируя крупные надмолекулярные комплексы.
Волокнистые протеины были идентифицированы только у животных. Эти белки выполняют функцию опорных компонентов некоторых тканей. Такая биологическая роль предъявляет повышенные требования к прочности и упорядоченности построения молекул. По этой причине фибриллярная структура белка отличается большей стабильностью по сравнению с глобулой.
Волокнистые протеины участвуют в формировании жестких структур, таких как:
- соединительная ткань;
- сухожилия;
- мышечные волокна.
Эти белки входят в состав различных покровных образований (эпидермис, волосы, шерсть и т. д.), выполняя защитные функции.
В естественной физиологической среде фибриллярные белки не присутствуют в растворе. Однако, если искусственно смешать молекулы волокнистого протеина с водой, образуется очень вязкая масса.
Примеры фибриллярных и глобулярных белков
К глобулярным белкам можно отнести все протеины, растворенные в межклеточной и внутриклеточной средах, а также в плазме крови. Сюда относят ферменты, белковые гормоны, факторы транскрипции, иммуноглобулины и так далее. Классическим образцом глобулярного белка можно назвать гемоглобин.
Сферические протеины выполняют множество функций, тогда как волокнистые — только структурную. Типичным примером фибриллярных белков являются коллаген, эластин и кератины. К группе волокнистых протеинов относят также фиброин, из которого состоит шелковая нить, и фибрин, формирующийся при полимеризации фибриногена в процессе свертывания крови.
Коллаген
Коллаген — самый распространенный фибриллярный протеин многоклеточных животных. Он входит в состав соединительной ткани, обеспечивая ее прочность и эластические свойства. Этот белок присутствует в:
- хрящах;
- дерме;
- сухожилиях;
- органическом матриксе костей;
- стенках сосудов;
- органическом материале костной ткани.
Коллаген состоит из трех аминокислотных цепей, скрученных в спираль и соединенных друг с другом ковалентными связями. Структурные единицы этого белка называются тропоколлагенами. Последние соединяются друг с другом концами, смещенными друг относительно друга на расстояние в 67 нанометров.
В зависимости от локализации в организме различают 28 типов коллагена. У всех разновидностей обязательно присутствует хотя бы один домен с тройной спиралью. Коллаген составляет основу всех типов соединительной ткани. Структурные компоненты этого белка образуют очень прочные фибриллы, которые способны выдерживать значительные нагрузки.
Коллаген выполняет опорные и защитные функции, а также обеспечивает эластичность тканей. Однако молекулы этого протеина не обладают способностью растягиваться. Резиноподобные свойства характерны для другого белка, также присутствующего в соединительных тканях, — эластина.
Кератины
Выделяют 2 основных разновидности кератинов: альфа и бета. В первую группу входят волокнистые белки, входящие в состав покровных образований позвоночных. Альфа-кератины составляют большую часть сухой массы:
- эпидермиса;
- волос и шерсти;
- когтей и ногтей;
- копыт, рогов, панцирей, игл и т. д.
Иными словами, кератины альфа-группы являются структурной основной для формирования производных кожи. Бета-разновидность этого типа волокнистых белков входит в состав паутины и шелка. Эти кератины более мягкие.
Жесткие белки альфа-группы выполняют защитные функции, а также обеспечивают прочность определенных анатомических частей (рога, копыта, клювы). За счет кератина происходит образование мозолей на поврежденной коже.
Эластин
Эластин — основной белковый компонент тканей, которые должны обладать высокими пластическими свойствами. Этот протеин входит в состав:
- артерий;
- легких;
- стенок мочевого пузыря;
- кожи;
- эластичных связок;
- хряща.
Как и другие фибриллярные белки, эластин строится из элементарных повторяющихся единиц. В этом случае в их качестве выступают небольшие молекулы весом 65 килодальтон, которые сшиваются с образованием нерастворимого комплекса. Каждая структурная единица называется протоэластином.
76-77
Áèîìîëåêóëû. Ïåïòèäû è áåëêè
Ñòðóêòóðíûå áåëêè
ïðèäàþò ýêñòðàöåëëþëÿðíûì ñòðóêòóðàì ìåõàíè÷åñêóþ ïðî÷íîñòü, à òàêæå ó÷àñòâóþò â ïîñòðîåíèè öèòîñêåëåòà
(ñì. ñ. 206). Â áîëüøèíñòâå ñòðóêòóðíûõ áåëêîâ ïðåîáëàäàåò îäíà èç
âòîðè÷íûõ ñòðóêòóð (ñì. ñ. 74), ÷òî ïðåäîïðåäåëÿåòñÿ èõ
àìèíîêèñëîòíûì ñîñòàâîì.
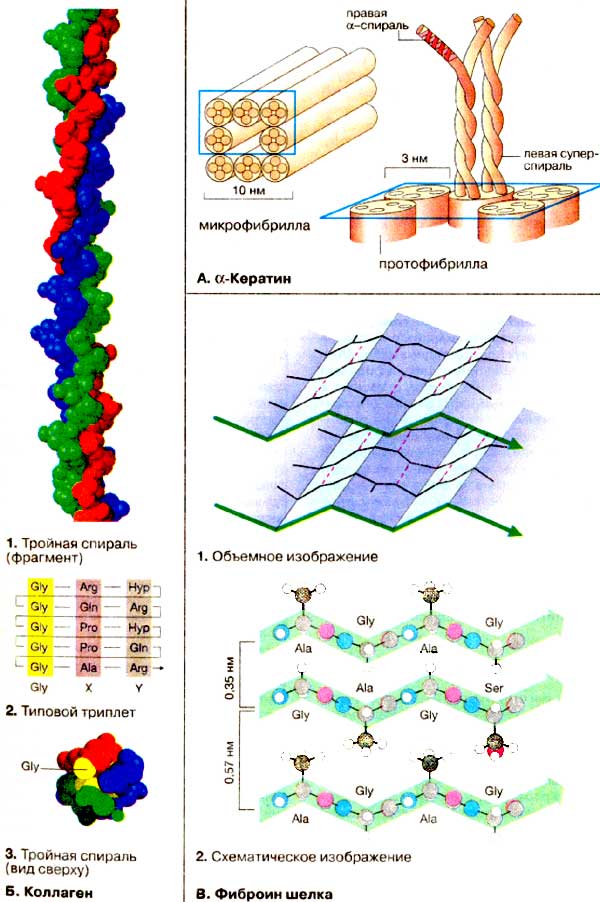
À. α-Êåðàòèí
Ñòðóêòóðíûì áåëêîì, ïîñòðîåííûì
ïðåèìóùåñòâåííî â âèäå α-ñïèðàëè, ÿâëÿåòñÿ α-êåðàòèí.
Âîëîñû (øåðñòü), ïåðüÿ, èãëû, êîãòè è êîïûòà æèâîòíûõ ñîñòîÿò ãëàâíûì
îáðàçîì èç êåðàòèíà.  êà÷åñòâå êîìïîíåíòà ïðîìåæóòî÷íûõ ôèëàìåíòîâ (ñì. ñ. 206)
êåðàòèí (öèòîêåðàòèí) ÿâëÿåòñÿ âàæíåéøåé ñîñòàâíîé ÷àñòüþ öèòîñêåëåòà.
 êåðàòèíàõ áîëüøàÿ ÷àñòü ïåïòèäíîé öåïè ñâåðíóòà â ïðàâóþ
α-ñïèðàëü. Äâå ïåïòèäíûå öåïè îáðàçóþò åäèíóþ ëåâóþ ñóïåðñïèðàëü,
êàê ýòî èìååò ìåñòî è â ìèîçèíå (ñì. ñ. 71). Ñóïåðñïèðàëèçîâàííûå
äèìåðû êåðàòèíà îáúåäèíÿþòñÿ â òåòðàìåðû, êîòîðûå àãðåãèðóþò ñ îáðàçîâàíèåì
ïðîòîôèáðèëë äèàìåòðîì 3 íì. Íàêîíåö, âîñåìü ïðîòîôèáðèëë îáðàçóþò ìèêðîôèáðèëëû
äèàìåòðîì 10 íì (ñì. ñ. 207).
Âîëîñû ïîñòðîåíû èç òàêèõ æå ôèáðèëë. Òàê, â
îòäåëüíîì âîëîêíå øåðñòè äèàìåòðîì 20 ìêì ïåðåïëåòåíû ìèëëèîíû ôèáðèëë.
Îòäåëüíûå öåïè êåðàòèíà ñêðåïëåíû ïîïåðå÷íî ìíîãî÷èñëåííûìè äèñóëüôèäíûìè
ñâÿçÿìè, ÷òî ïðèäàåò èì äîïîëíèòåëüíóþ ïðî÷íîñòü. Ïðè õèìè÷åñêîé çàâèâêå
ïðîèñõîäÿò ñëåäóþùèå ïðîöåññû: âíà÷àëå ïóòåì âîññòàíîâëåíèÿ òèîëàìè ðàçðóøàþòñÿ
äèñóëüôèäíûå ìîñòèêè, à çàòåì äëÿ ïðèäàíèÿ âîëîñàì íåîáõîäèìîé ôîðìû èõ
âûñóøèâàþò ïðè íàãðåâàíèè. Ïðè ýòîì çà ñ÷åò îêèñëåíèÿ êèñëîðîäîì âîçäóõà
îáðàçóþòñÿ íîâûå äèñóëüôèäíûå ìîñòèêè, êîòîðûå ñîõðàíÿþò ôîðìó
ïðè÷åñêè.
Á. Êîëëàãåí
 îðãàíèçìå ìëåêîïèòàþùèõ êîëëàãåí ïðåîáëàäàþùèé â
êîëè÷åñòâåííîì îòíîøåíèè áåëîê: îí ñîñòàâëÿåò 25% îáùåãî áåëêà. Êîëëàãåí ïðèñóòñòâóåò
â ðàçëè÷íûõ ôîðìàõ ïðåæäå âñåãî â ñîåäèíèòåëüíîé òêàíè. Ýòîò áåëîê èìååò íåîáû÷íûé
àìèíîêèñëîòíûé ñîñòàâ: 1/Ç ñîñòàâëÿâ ãëèöèí (Gly). ïðèìåðíî 10% ïðîëèí
(Ðrî), à òàêæå ãèäðîêñèïðîëèí (Hyp) è ãèäðîêñèëèçèí (Hyl).
Ïîñëåäíèå äâå àìèíîêèñëîòû îáðàçóþòñÿ ïîñëå áèîñèíòåçà êîëëàãåíà ïóòåì ïîñòòðàíñëÿöèîííîé
ìîäèôèêàöèè (ñì. ñ. 334). Â ñòðóêòóðå êîëëàãåíà ïîñòîÿííî ïîâòîðÿåòñÿ
òðèïëåò Gly-X-Y (2), ïðè÷åì ïîëîæåíèå X ÷àñòî çàíèìàåò
ïðîëèí, à Y ãèäðîêñèëèçèí. Èìåþòñÿ âåñêèå îñíîâàíèÿ òîìó, ÷òî êîëëàãåí
ïîâñåìåñòíî ïðèñóòñòâóåò â âèäå ïðàâîé òðîéíîé ñïèðàëè, ñêðó÷åííîé èç
òðåõ ïåðâè÷íûõ ëåâûõ ñïèðàëåé (1) (ñì. ñ. 74).
 òðîéíîé ñïèðàëè êàæäûé òðåòèé îñòàòîê îêàçûâàåòñÿ â öåíòðå,
ãäå ïî ñòåðè÷åñêèì ïðè÷èíàì ïîìåùàåòñÿ òîëüêî ãëèöèí (3,
îñòàòîê ãëèöèíà îêðàøåí â æåëòûé öâåò). Çäåñü ïðåäñòàâëåí íåáîëüøîé ôðàãìåíò
òðîéíîé ñïèðàëè. Âñÿ ìîëåêóëà êîëëàãåíà èìååò äëèíó îêîëî 300 íì.
Â. Ôèáðîèí øåëêà
Øåëê ïîëó÷àþò èç êîêîíîâ ãóñåíèö òóòîâîãî øåëêîïðÿäà (Âîmbóõ
mori) è ðîäñòâåííûõ âèäîâ. Ocíîâíîé áåëîê øåëêà, ôèáðîèí, îáëàäàåò
ñòðóêòóðîé àíòèïàðàëëåëüíîãî ñêëàä÷àòîãî ëèñòà, ïðè÷åì ñàìè ëèñòû ðàñïîëàãàþòñÿ
ïàðàëëåëüíî äðóã äðóãó, îáðàçóÿ ìíîãî÷èñëåííûå ïëàñòû (1).
Òàê êàê â ñêëàä÷àòûõ ñòðóêòóðàõ áîêîâûå öåïè àìèíîêèñëîòíûõ îñòàòêîâ îðèåíòèðîâàíû
âåðòèêàëüíî ââåðõ è âíèç, â ïðîìåæóòêàõ ìåæäó îòäåëüíûìè ñëîÿìè ìîãóò ïîìåñòèòüñÿ
ëèøü êîìïàêòíûå ãðóïïèðîâêè. Ôàêòè÷åñêè ôèáðîèí ñîñòîèò íà 80% èç ãëèöèíà, àëàíèíà
è ñåðèíà, ò.å. èç òðåõ àìèíîêèñëîò, õàðàêòåðèçóþùèõñÿ ìèíèìàëüíûìè ðàçìåðàìè
áîêîâûõ öåïåé. Ìîëåêóëà ôèáðîèíà ñîäåðæèò òèïè÷íûé ïîâòîðÿþùèéñÿ ôðàãìåíò (Gly-Ala-GIy-AIa-GIy-Ser)n
. Óñòàíîâëåíî, ÷òî â ôèáðîèíå ïðîìåæóòîê ìåæäó ñêëàä÷àòûìè ñëîÿìè
ñîñòàâëÿåò 0,35 è 0,57 íì.  ïåðâîì ñëó÷àå â ïðîìåæóòîê îðèåíòèðîâàí ãëèöèí
(R = H). Ïðîìåæóòîê 0,57 íì ñîçäàåòñÿ çà ñ÷åò îòòàëêèâàíèÿ áîêîâûõ öåïåé ñåðèíà
è àëàíèíà (2).
Как заправить (забить) вкусный кальян в домашних условиях | Mirk
СДЕЛАЛ КАЛЬЯН ИЗ КОЛЫ СВОИМИ РУКАМИ
Как приготовить протеин и гейнер в домашних условиях?
Наш проект живет и развивается для тех, кто ищет ответы на свои вопросы и стремится не потеряться в бушующем море зачастую бесполезной информации. На этой странице мы рассказали (а точнее — показали 🙂 вам Как сделать фиброин в домашних условиях. Кроме этого, мы нашли и добавили для вас тысячи других видеороликов, способных ответить, кажется, на любой ваш вопрос. Однако, если на сайте все же не оказалось интересующей информации — напишите нам, мы подготовим ее для вас и добавим на наш сайт!
Если вам не сложно — оставьте, пожалуйста, свой отзыв, насколько полной и полезной была размещенная на нашем сайте информация о том, Как сделать фиброин в домашних условиях.